ЭНТАЛЬПИЯ (от греч. enthalpo - нагреваю)
(теплосодержание, тепловая функция Гиббса), потенциал термодинамический, характеризующий
состояние термодинамической системы при выборе в качестве осн. независимых
переменных энтропии S и давления р. Обозначается H(S, р, N, хi),
где N - число частиц системы, xi - др. макроскопич. параметры
системы. Э.- аддитивная функция, т. е. Э. всей системы равна сумме Э.
составляющих её частей; с внутр. энергией U системы Э. связана
соотношением
Н = U + pV, (1) где V - объём системы.
Полный дифференциал Э. (при неизменных N и xi) имеет вид:
dH = TdS + Vdp. (2) Из формулы (2) можно определить темп-ру Т и
объём системы:
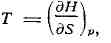
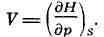
При постоянном давлении (р
= const) теплоёмкость системы cp =
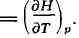
Эти свойства Э. при р =
const
аналогичны свойствам внутр.
энергии при постоянном объёме:
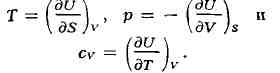
Равновесному состоянию
системы в условиях постоянства S и p соответствует минимальное значение
Э. Изменение Э. (&H) равно количеству теплоты, к-рое сообщают системе или
отводят от неё при постоянном давлении, поэтому значения &Н характеризуют
тепловые эффекты фазовых переходов (плавления, кипения и т. д.), химич.
реакций и др. процессов, протекающих при постоянном давлении. При тепловой
изоляции тел (в условиях р - const) Э. сохраняется, поэтому её называют
иногда теплосодержанием или тепловой функцией. Условие сохранения Э. лежит, в
частности, в основе теории Джоуля - Томсона эффекта, нашедшего важное
практич. применение при сжижении газов. Термин "Э." был
предложен X. Камерлинг-Оннесом.
Д. Н. Зубарев.