ХЛОР (лат. Chlorum), C1, хим. элемент VII группы периодич. системы
Менделеева, ат. н. 17, ат. м. 35,453; относится к семейству галогенов. При
нормальных условиях (0°С, 0,1 Мн/м2, или 1 кгс/см2)
жёлто-зелёный газ с резким раздражающим запахом. Природный X. состоит из
двух стабильных изотопов: 35С1 (75,77%) и 37С1 (24,23%).
Искусственно получены радиоактивные изотопы с массовыми числами 32, 33, 34, 36,
38, 39, 40 и периодами полураспада (T½) соответственно
0,31; 2,5; 1,56 сек; 3,1-105 лет; 37,3, 55,5 и 1,4 мин. 36С1
и 38С1 используются как изотопные индикаторы.
Историческая справка. X. получен впервые в 1774 К. Шееле взаимодействием
соляной к-ты с пиролюзитом МпО2. Однако только в 1810 Г. Дэви установил,
что хлор - элемент и назвал его chlorine (от греч. chlords - жёлто-зелёный). В
1813 Ж. Л. Гей-Люссак предложил для этого элемента назв. X.
Распространение в природе. X. встречается в природе только в виде
соединений. Среднее содержание X. в земной коре (кларк) 1,7-10~2% по
массе, в кислых изверженных породах- гранитах и др. 2,4-10~2, в
основных и ультраосновных 5-10~3. Осн. роль в истории X. в земной
коре играет водная миграция. В виде иона С1~ он содержится в Мировом океане
(1,93%), подземных рассолах и соляных озёрах. Число собственных минералов
(преим. хлоридов природных) 97, гл. из них галит NaCl (см. Каменная
соль). Известны также крупные месторождения хлоридов калия и магния и
смешанных хлоридов: сильвин КС1, сильвинит (Na,K)Cl, карналит
KCl*MgCl2*6H2O, каинит KCl-MgSO4*3H2O,
бишофит MgCl2-6H2O. В истории Земли большое значение
имело поступление содержащегося в вулканич. газах НС1 в верхние части земной
коры.
Физические и химические свойства. X. имеет tКип -34,05°С, tпл
-101°С. Плотность газообразного X. при нормальных условиях 3,214 г/л; насыщенного
пара при 0°С 12,21 г/л; жидкого X. при темп-ре кипения 1,557 г/см3;
твёрдого X. при - 102°С 1,9 г/см3. Давление насыщенных
паров X. при 0°С 0,369; при 25°С 0,772; при 100°С 3,814 Мн/м2 или
соответственно 3,69; 7,72; 38,14 кгс/см2. Теплота плавления 90,3 кдж/кг
(21,5 кал/г); теплота испарения 288 кдж/кг (68,8
кал/г); теплоёмкость
газа при постоянном давлении 0,48 кдж/(кг*К) [0,11 кал/(г*°С)]. Критич.
константы X.: темп-pa 144°С, давление 7,72 Мн/м2 (77,2 кгс/см2),
плотность 573 г/л, удельный объём 1,745•10-3 л/г. Растворимость
(в г/л) X. при парциальном давлении 0,1 Мн/м2, или 1 кгс/см2,
в воде 14,8 (0°С), 5,8 (30°С), 2,8 (70°С); в растворе 300 г/л NaCl 1,42
(30°С), 0,64 (70°С). Ниже 9,6°С в водных растворах образуются гидраты X.
переменного состава С12-nН2О (где n = 6-:-8); это жёлтые
кристаллы кубич. сингонии, разлагающиеся при повышении темп-ры на X. и воду. X.
хорошо растворяется в TiCl4, SiCl4, SnCl4 и
нек-рых органич. растворителях (особенно в гексане С6Ни и
четырёххлористом углероде CCU). Молекула X. двухатомна (С12).
Степень термич. диссоциации С12 + 243кдж ->-<-2С1 при
1000 К равна 2,07*10-4 %, при 2500 К 0,909%.
Внешняя электронная конфигурация атома Cl 3s2 Зр5. В
соответствии с этим X. в соединениях проявляет степени окисления- 1,+ 1, + 3,
+ 4, + 5 -4-6 и +7. Ковалентный радиус атома 0,99А, ионный радиус Cl-
1.82А, сродство атома X. к электрону 3,65 эв, энергия ионизации 12,97 эв.
Химически X. очень активен, непосредственно соединяется почти со всеми
металлами (с нек-рыми только в присутствии влаги или при нагревании) и с
неметаллами (кроме углерода, азота, кислорода, инертных газов), образуя
соответствующие хлориды, вступает в реакцию со мн. соединениями,
замещает водород в предельных углеводородах и присоединяется к ненасыщенным
соединениям. X. вытесняет бром и иод из их соединений с водородом и металлами;
из соединений X. с этими элементами он вытесняется фтором. Щелочные металлы в
присутствии следов влаги взаимодействуют с X. с воспламенением, большинство
металлов реагирует с сухим X. только при нагревании. Сталь, а также нек-рые
металлы стойки в атмосфере сухого X. в условиях невысоких темп-р, поэтому их
используют для изготовления аппаратуры и хранилищ для сухого X. Фосфор
воспламеняется в атмосфере X., образуя РС13, а при дальнейшем
хлорировании -РСl5; сера с X. при нагревании даёт S2C12,
SCl2 и др. SnClm. Мышьяк, сурьма, висмут,
стронций, теллур энергично взаимодействуют с X. Смесь X. с водородом горит
бесцветным или жёлто-зелёным пламенем с образованием хлористого водорода (это
цепная реакция).
Максимальная темп-pa водородно-хлорного пламени 2200°С. Смеси X. с
водородом, содержащие от 5,8 до 88,5% Н2, взрывоопасны.
С кислородом X. образует окислы: С12О, СlO2, С12О6,
Сl2О7, С12О8 (см. Хлора окислы),
а также гипохлориты (соли хлорноватистой кислоты), хлориты,
хлораты и
перхлораты. Все кислородные соединения хлора образуют взрывоопасные смеси с
легко окисляющимися веществами. Окислы X. малостойки и могут самопроизвольно
взрываться, гипохлориты при хранении медленно разлагаются, хлораты и перхлораты
могут взрываться под влиянием инициаторов.
X. в воде гидролизуется, образуя хлорноватистую и соляную к-ты: С12
+ + Н2О->-<-НС1О + НС1. При хлорировании водных растворов
щелочей на холоду образуются гипохлориты и хлориды: 2NaOH + C12=
NaCIO + NaCl + Н2О, а при нагревании - хлораты. Хлорированием сухой
гидроокиси кальция получают хлорную известь.
При взаимодействии аммиака с X. образуется трёххлористый азот (см.
Хлориды азота). При хлорировании органич. соединений X. либо замещает
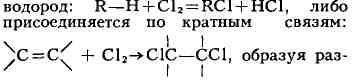
личные хлорсодержащие органич. соединения (см. Хлорирование).
X. образует с др. галогенами межгалогенные соединения. Фториды C1F,
C1F3, ClF3 очень реакционноспособны; напр., в атмосфере
C1F3 стеклянная вата самовоспламеняется. Известны соединения хлора с
кислородом и фтором - оксифториды X.: C1O3F, C1O2F3,
C1OF, C1OF3 и перхлорат фтора FC1O4.
Получение. X. начали производить в пром-сти в 1785 взаимодействием соляной
к-ты с двуокисью марганца или пиролюзитом. В 1867 англ. химик Г. Дикон
разработал способ получения X. окислением НСl кислородом воздуха в присутствии
катализатора. С кон. 19 - нач. 20 вв. X. получают электролизом водных растворов
хлоридов щелочных металлов. По этим методам в 70-х гг. 20 в. производится
90-95% X. в мире. Небольшие кол-ва X. получаются попутно при произ-ве магния,
кальция, натрия и лития электролизом расплавленных хлоридов. В 1975 мировое
произ-во X. составляло ок. 25 млн. т. Применяются два осн. метода
электролиза водных растворов NaCl: 1) в электролизёрах с твёрдым катодом и
пористой фильтрующей диафрагмой; 2) в электролизёрах с ртутным катодом. По
обоим методам на графитовом или окисном титано-рутениевом аноде выделяется
газообразный X. По первому методу на катоде выделяется водород и образуется
раствор NaOH и NaCl, из к-рого последующей переработкой выделяют товарную
каустич. соду. По второму методу на катоде образуется амальгама натрия, при её
разложении чистой водой в отдельном аппарате получаются раствор NaOH, водород и
чистая ртуть, к-рая вновь идёт в производство. Оба метода дают на 1 т X.
1,125 га NaOH.
Электролиз с диафрагмой требует меньших капиталовложений для организации
произ-ва X., даёт более дешёвый NaOH. Метод с ртутным катодом позволяет
получать очень чистый NaOH, но потери ртути загрязняют окружающую среду. В 1970
по методу с ртутным катодом производилось 62,2% мировой выработки X., с твёрдым
катодом 33,6% и пр. способами 4,2%. После 1970 начали применять электролиз с
твёрдым катодом и ионообменной мембраной, позволяющий получать чистый NaOH без
использования ртути.
Применение. Одной из важных отраслей хим. пром-сти является хлорная
пром-сть. Осн. количества X. перерабатываются на месте его произ-ва в
хлорсодержащие соединения. Хранят и перевозят X. в жидком виде в баллонах,
бочках, ж.-д. цистернах или в специально оборудованных судах. Для
индустриальных стран характерно следующее примерное потребление X.: на произ-во
хлорсодержащих органич. соединений - 60-75%; неорганич. соединений, содержащих
X., -10-20%; на отбелку целлюлозы и тканей - 5-15%; на санитарные нужды и
хлорирование воды - 2-6% от общей выработки.
X. применяется также для хлорирования нек-рых руд с целью извлечения титана,
ниобия, циркония и др.
О хлорсодержащих органич. соединениях см. Винилхлорид, Хлоропрен,
Винилиденхлорид, Четырёххлористый углерод, Хлороформ,
Метиленхлорид, Тетрахлорэтан, Трихлорэтилен, Хлорбензол и др. О
хлорсодержащих неорганич. соединениях см. Соляная кислота. Натрия хлорид.
Калия хлорид, Кальция хлорид, Хлора окислы, Хлорная известь и др.
Л. М.
Якименко.
X. в организме. X. - один из биогенных элементов, постоянный
компонент тканей растений и животных. Содержание X. в растениях (много X. в
галофитах) - от тысячных долей процента до целых процентов, у животных -десятые и
сотые доли процента. Суточная потребность взрослого человека в X. (2-4 г) покрывается
за счёт пищевых продуктов. С пищей X. поступает обычно в избытке в виде хлорида
натрия и хлорида калия. Особенно богаты X. хлеб, мясные и молочные продукты. В
организме животных X. - осн. осмотически активное вещество плазмы крови, лимфы,
спинномозговой жидкости и нек-рых тканей. Играет роль в водно-солевом
обмене, способствуя удержанию тканями воды. Регуляция кислотно-щелочного
равновесия в тканях осуществляется наряду с др. процессами путём изменения в
распределении X. между кровью и др. тканями. X. участвует в энергетич. обмене у
растений, активируя как окислительное фосфорилирование, так и
фотофосфорилирование. X. положительно влияет на поглощение корнями кислорода.
X. необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами.
В состав большинства питательных сред для искусственного культивирования
растении X. не входит. Возможно, для развития растений достаточны весьма малые
концентрации X.
М. Я. Школьник.
Отравления X. возможны в хим., цел.-бум., текст., фармацевтич. пром-сти и
др. X. раздражает слизистые оболочки глаз и дыхат. путей. К первичным
воспалительным изменениям обычно присоединяется вторичная инфекция. Острое
отравление развивается почти немедленно. При вдыхании ср. и низких концентраций
X. отмечаются стеснение и боль в груди, сухой кашель, учащённое дыхание, резь в
глазах, слезотечение, повышение содержания лейкоцитов в крови, темп-ры тела и
т. п. Возможны бронхопневмония, токсич. отёк лёгких, депрессивные состояния,
судороги. В лёгких случаях выздоровление наступает через 3-7 сут. Как
отдалённые последствия наблюдаются катары верхних дыхательных путей,
рецидивирующий бронхит, пневмосклероз и др.; возможна активизация туберкулёза
лёгких. При длит, вдыхании небольших концентрации X. наблюдаются аналогичные,
но медленно развивающиеся формы заболевания. Профилактика отравлений:
герметизация производств, оборудования, эффективная вентиляция, при
необходимости использование противогаза. Предельно допустимая концентрация X. в
воздухе производств, помещений 1 мг!м3. Произ-во X., хлорной
извести и др. хлорсодержащих соединений относится к проиэ-вам с вредными
условиями труда, где по сов. законодательству ограничено применение труда
женщин и несовершеннолетних.
Л. А. Каспаров.
Лит.:
Якименко Л. М., Производство хлора, каустической соды и
неорганических хлорпродуктов, М., 1974; Некрасов Б. В., Основы общей химии, 3
изд., [т.] 1, М., 1973; Вредные вещества в промышленности, под ред. Н. В. Лазарева, 6 изд., т. 2, Л., 1971;
Comprehensive inorganic chemistry, ed. J. С. Bailar [a. o.], v. 1 - 5, Oxf.- [a.
o.], 1973.
ХЛОРА ОКИСЛЫ, соединения хлора с кислородом: С12О, С1О2,
С12Об, С12О7, С12О8.
X. окись (оксид хлора, ангидрид хлорноватистой кислоты), С12О,
жёлто-коричневый газ с резким запахом, похожим на запах хлора; tпл -121 0С;
tкип 2 °С. Энергичный окислитель; нестойкое соединение, в обычных условиях
медленно разлагается, в концентрированном и сжиженном виде может самопроизвольно
взрываться: 2СlО = 2С12 + + О2. Хорошо растворима в воде
(в 1 объёме воды ок. 200 объёмов С12О) и четырёххлористом углероде;
при растворении в воде образуется хлорноватистая к-та НС1О. Может быть получена
взаимодействием хлора со свежеосаждённой сухой окисью ртути: 2HgO + 2Cl2
= HgCl2 + + С12О. В пром-сти получают водные растворы
окиси хлора хлорированием карбонатов щелочных или щёлочноземельных металлов в
воде. Используют окись хлора для произ-ва гипохлорита кальция.
X. двуокись (диоксид хлора, смешанный ангидрид хлористой кислоты и
хлорноватой кислоты), С1О2, желтовато-оранжевый газ с неприятным запахом;
tпл -59 0С; tкнп 10 0С. Энергичный окислитель (особенно в
кислой среде); в концентрированном виде взрывается; на свету постепенно
разлагается, выше 50°С разложение сопровождается взрывом. Хорошо растворима в
воде, серной и уксусной к-тах, четырёххлористом углероде. При взаимодействии с
щелочными растворами образует хлориты и хлораты. Получают СlO2
частичным восстановлением хлоратов SO2, щавелевой или соляной
к-тами; в малых кол-вах действием хлора на хлорит натрия:
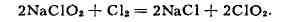
Широко используется в виде водного раствора или в газообразном виде в смеси с
воздухом для отбелки и стерилизации целлюлозы, тканей, муки. Взаимодействие С1О2
с водными растворами NaOH в присутствии восстановителя используют для пром.
получения хлоритов. X. трёхокись (смешанный ангидрид хлорной кислоты и
хлорноватой кислоты), С12О6, дымящая жидкость
тёмно-красного цвета; tпл 3,5 0С; tкип 203°С;
при контакте с легкоокисляющимися веществами взрывается. В кристаллич.
состоянии имеет строение перхлората хлорида ClO2 C1O4.
Энергично реагирует с водой. Может быть получена окислением двуокиси хлора
озоном или взаимодействием хлоратов с фтором: 2КСlOз + F2 = 2КF + Сl2О6
*С12О6 всегда присутствует в продуктах термин, разложения
хлорной к-ты. Практич. применения не находит.
Хлорный ангидрид, С12О7, бесцветная жидкость; tпл
-93 °С; tкип 83°С; при хранении медленно разлагается и окрашивается
продуктами распада - низшими окислами хлора. С12О7,
особенно загрязнённый продуктами распада, самопроизвольно взрывается. При
комнатной темп-ре растворяется в четырёххлористом углероде. С водой реагирует с
образованием хлорной к-ты. При контакте с иодом взрывается. С12О7
может быть получен обезвоживанием хлорной к-ты фосфорным ангидридом или
олеумом, а также при низкотемпературном электролизе концентрированной хлорной
к-ты на платиновом аноде. Практич. применения не имеет.
С12О8 - промежуточный продукт при электролизе хлорной
к-ты и её солей. В индивидуальном состоянии не выделен.
Помимо перечисленных кислородных соединений хлора в лит-ре упоминается С12О4,
отвечающее структуре перхлори-та хлора С1ОСlO3; может быть получено
взаимодействием фторсульфоната хлора и CsClO.
Лит. см. при ст. Хлор.
Л. М. Якименко.
ХЛОРАЛГИДРАТ, лекарственный препарат; см. в ст. Хлоралъгидрат.
ХЛОРАЛЬ, трихлоруксусный альдегид, ССl3СНО, бесцветная
жидкость с резким запахом, Tкип 97,75 °С. X. энергично
взаимодействует с водой, спиртом, аммиаком, образуя хорошо кристаллизующиеся
продукты (см. Хлоралъгидрат). Получают хлорированием этилового спирта;
используют в произ-ве инсектицидов, напр, хлорофоса,
4,4-дихлордифенил-трихлорэтана (т. н. ДДТ), гербицидов, трихлоруксусной
к-ты, хлороформа.
ХЛОРАЛЬГИДРАТ, 2,2,2-трихлор-этандиол-1,1 ,СС13СН(ОН)2,
бесцветные кристаллы, растворимые в воде, спирте и эфире, Tпл 53 °С. Получают
X. взаимодействием хлораля с водой. X.- лекарственный препарат из группы
снотворных средств. Обладает также успокаивающим, аналгезирующим и
противосудорожным действием. Применяют внутрь (в порошках и таблетках) и в
клизмах преимущественно при нарушениях сна, психическом возбуждении, эпилепсии;
входит в состав зубных капель "Дента".
ХЛОРАМИНОМЕТРИЯ, титриметрич. метод определения восстановителей;
основан на применении титрованных растворов хлораминов - хлорамина Т или
хлорамина Б. Реагенты проявляют окислительные свойства только в присутствии
гало-генид-ионов. Конечную точку титрования устанавливают визуально с помощью
различных индикаторов, потенциометрически или амперометрически с платиновым
вращающимся микроэлектродом. X. используется для определения, напр As (HI), Sb
(IH-), Hg (I), Fe (II), I-, азотсодержащих (нитриты), серусодержащих
(сероводород и его производные, сульфиты) соединений, альдегидов, кетонов и
др. неорганич. и органич. соединений.
Лит.: Берка А., Вултерин Я.,
Зыка Я., Новые редоксметоды в
аналитической химии, М., 1968, с. 61-84.
ХЛОРАМИНЫ, хлорпроизводные аммиака (неорганич. X.) и аминов (органич.
X.), в молекулах к-рых атом хлора связан с азотом. О неорганич. X. см. ст. Хлориды
азота.
Органич. X.- жидкости или твёрдые вещества, обладающие резким запахом;
раздражают верхние дыхательные пути. Напр., N-хлордиметиламин (CH3)2NC1
кипит при 46 °С, N, N-дихлорметиламин CH3NC12 - при
58-60 0С, N,N-дихлорэтиламин C2HsNCl2 и
М-хлордиэтиламин (C2Hs)2NCl - при 91 °С;
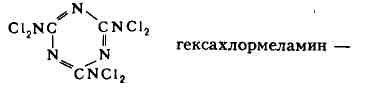
желтоватые кристаллы, tnл149 °С. Водой (в т. ч. влагой
воздуха) X. разлагаются с образованием амина и хлорноватистой к-ты НОС1;
растворы X. в органич. растворителях довольно устойчивы. Получают X. действием
хлора или хлорноватистой к-ты на амины и их соли.
Очень часто назв. "хлорамины" применяют для обозначения
N-хлорпроизводных амидов органич. и неорганич. к-т. Большое практическое
применение нашли хлор- и дихлорамиды ароматич. сульфокислот, напр. т. н.
хлорамин Б C6H5SO2NNaCl*3H2O (натриевая соль N-хлорамида
бензолсульфокислоты), хлорамин Т (CH3)СН4SO2NNaCl-3H2O
(натриевая соль N-хлорамида и-толуол-сульфокислоты) - бесцветные кристаллы, tпл
180-185°С и 175-180°С соответственно, хорошо растворимы в воде и спирте;
дихлорамин Б (N, N-дихлорбензол-сульфамид) и дихлорамин Т
(N,N-дихлор-и-толуолсульфамид)- кристаллы с запахом хлора, (tпл =
69-72 0С и 80-83 0С соответственно, нерастворимы в воде,
растворяются в органич. растворителях (обычно используют дихлорэтан).
X. обладают окислительным и хлорирующим действием, благодаря чему их
используют в аналитич. химии (см. Хлораминометрия), технике, напр, в
текстильной пром-сти для отбеливания тканей, для дегазации нек-рых отравляющих
веществ (см. Дегазирующие вещества). Вмедицине Х. применяют в
качестве антисептических средств (гл. обр. хлорамин Б, содержащий 25-29%
активного хлора и оказывающий также дезодорирующее и сперматоцидное действие).
Для дезинфекции рук используют 0,25-0,5%-ные растворы хлорамина Б, а для
обеззараживания предметов ухода и выделений больных при кишечных и капельных
инфекциях - 1-5%-ные растворы, а также хлорамин Т, дихлорамин. X. применяют для
хлорирования воды (таблетки "пантоцид"), лечения
инфицированных ран, дезинфекции рук, неметаллич. инструментария.
ХЛОРАНГИДРИДЫ, см. Галогенангидриды.
ХЛОРАТОР, аппарат (установка) для дозирования газообразного хлора
(хлор-газа) и приготовления его водного раствора (хлорной воды), применяемый
при обеззараживании (дезинфекции) природных и сточных вод. Различают X.
напорные и вакуумные. Последние (получившие наибольшее распространение) обычно
состоят из баллона, в к-ром осаждаются из хлор-газа капли жидкости, пыль и т.
п., регулировочного вентиля, фильтра для окончательной очистки газа, редуктора,
понижающего давление, измерителя расхода газа и смесителя хлор-газа с водой. X.
наз. также аппараты, используемые в хим. технологии для хлорирования органич. и
неорганич. соединений.
ХЛОРАТ-ХЛОРИД КАЛЬЦИЯ [смесь Са(С1О3)2 с СаС12],
хим. препарат, применяется в виде водного раствора на посевах хлопчатника и др.
культур как дефолиант и десикант.
ХЛОРАТЫ, хлорноватокислые сол и, соли хлорноватой кислоты НСlO3;
кристаллы, устойчивые при обычной темп-ре, разлагающиеся при нагревании или в
присутствии катализаторов с выделением кислорода. Большинство X. хорошо
растворимо в воде и в нек-рых органич. растворителях; с органич. и легко
окисляющимися веществами образуют взрывчатые смеси. В пром. масштабе
производятся X. натрия, калия, кальция и магния.
Хлорат калия (хлорноватокислый калий, бертоллетова соль), КСlО3;
плотность 2,344 г/см3, tпл 370°С. Впервые получен
в 1786 К. Л. Бертолле (отсюда назв. бертоллетова соль) при пропускании
хлора в концентрированный раствор едкого кали. Растворимость X. калия в воде (в
г/л): 32,4 (0 °С), 170,5 (50 °С), 437 (100 °С). КС1О3
негигроскопичен. X. калия разлагается с выделением кислорода при температуре
ок. 400 °С, а в присутствии катализаторов (MnO2, Fe2O3
и др.) - при темп-ре ок. 150-200 °С. Химически чистый КСЮ3 взрывается
при 550-600 °С. В смеси с серой, фосфором, мн. органич. веществами взрывается
при ударе или трении. Чувствительность к взрыву возрастает в присутствии
броматов и аммониевых солей. Получается при обменном разложении X. кальция или
натрия с КС1. Применяется в произ-ве спичек и пиротехнич. составов.
Хлорат натрия, NaClO3; плотность 2,49 г /см3 (15°С);
tпл 248 0С. Растворимость в воде (в г/л): 612 (О °С), 870
(50 °С), 1190 (100 °С). Малогигроскопичен. По хим. свойствам сходен с КС1О3.
Получают электролизом водных растворов NaCl в бездиафрагменных электролизёрах.
Используется для получения двуокиси хлора (см. Хлора окислы), в
производстве др. хлоратов и перхлоратов.
Хлорат кальция, Са(С1О3)2. Очень гигроскопичен;
образует с водой кристаллогидраты Са(СЮ3)2-nН2О
(где п =1 -:- 6); на воздухе расплывается. X. к. получается хлорированием
известкового молока:
6Са(ОН)2+6С1г = Са(СЮ3)2+5СаСЬ+
6Н2О.
Используется как промежуточный продукт в произ-ве X. калия, в с. х-ве служит
в качестве гербицида и дефолианта.
Хлорат магния, Mg(ClO3)2. Очень гигроскопичен,
образует с водой кристаллогидраты, напр. Mg(ClO3)2-6H2O;
безводный X. м. не получен. На воздухе расплывается. Кристаллогидрат получают
сплавлением X. натрия с бишофитом: 2NaClO3 + MgCl2-6H2O
= = Mg(ClO3)2-6H2O + 2NaCl. Огне- и взрывоопасен.
Применяется для предуборочного удаления листьев с хлопчатника и для десикации
подсолнечника, риса, семенников зернобобовых культур, высадок сахарной
свёклы и др.
X. малотоксичны; хронич. отравления возникают при попадании внутрь и
вдыхании пыли.
Лит. см. при ст. Хлор.
Л. М. Якименко.
ХЛОРАЦЕТОФЕНОН,С6Н5С(О)СН2С1,
бесцветные кристаллы, tпл 59 °С, Лшп 244-245°С, летучесть (макс.
концентрация) 0,11 мг/л (20°С); обладает очень сильным слезоточивым
действием (лакриматор). X. плохо растворим в воде, хорошо - в органических
растворителях, гидролитически устойчив, на холоду практически не гидролизуется
даже водными растворами щелочей; энергично реагирует со спиртовыми растворами
Na2S с образованием нетоксичного дифенацилсульфида (C6H5COCH2)2S.
X. получают хлорированием ацетофенона. Минимально действующая концентрация
0,0001 мг/л; непереносимая 0,002 мг/л (2 мин). Защитой
служит противогаз. Был предложен как отравляющее вещество в конце
1-й мировой войны 1914-18, но в боевой обстановке испытан не был.
О-ХЛОРБЕНЗАЛЬМАЛОНОДИНИТРИЛ, см. Орто-хлорбензальмалоно-динитрил.
ХЛОРБЕНЗИД, хлорпарацид, 4 - хлорфенил -4' - хлорбензилсульфид
(4-С1СбН45СН2С6Н4С1-4), хим.
препарат для борьбы с растительноядными клещами (акарицид).
ХЛОРБЕНЗИЛАТ [(CICeHOa C(OH) COOCjHs], хим. препарат для борьбы с растительноядными
клещами (акарицид).
ХЛОРБЕНЗОЛ, бесцветная жидкость с характерным запахом,
tкип
131,7°С; практически нерастворим в воде, смешивается со мн. органич.
растворителями. В пром-сти X. получают каталитич. хлорированием бензола (75-85
°С, металлич. железо); используют его в производстве фенола, 4,4'-дихлордифенил-трихлорэтана
(ДДТ), полупродуктов в синтезе красителей и как растворитель в лабораторной
практике.
ХЛОРБУТИЛКАУЧУК, продукт хлорирования бутилкаучука.
ХЛОРЕЛЛА (Chlorella), род микроскопич. одноклеточных зелёных
водорослей из класса протококковых. Клетки шаровидные или эллипсоидные, с
целлюлозной оболочкой, содержащие один пристенный хлоропласт с пиреноидом или без
него и одно ядро; запасные продукты - крахмал и масло. Размножение автоспорами.
В СССР ок. 10 видов, распространены повсеместно. Объект массового
культивирования в качестве возможного источника пищи и корма, для биологической
очистки сточных вод, регенерации воздуха в замкнутых экосистемах (на космич.
кораблях, подводных лодках).
Лит.: Музафаров А. М., Таубаев Т. Т., Селяметов Р. А., Хлорелла и ее
использование в животноводстве, Таш., 1974; Андреева В. М., Род Chlorella.
Морфология, систематика, принципы классификации, Л., 1975; Fott В.,
Novakоva M., A
monograph of the genus Chlorella. The fresh water species, в кн.: Studies in phycology, Prague, 1969.
ХЛОРИДОВОЗГОНКА, один из процессов хлорирования в цветной
металлургии, имеющий целью отогнать образующиеся при обжиге хлориды металлов в
газовую фазу и отделить их от непрохлорированной массы материала. Процесс
основан на большой летучести хлоридов мн. металлов и осуществляется при
темп-pax, обеспечивающих высокое давление паров возгоняемых хлоридов и быстрое
их улетучивание. X. ведут в трубчатых и шахтных печах, электропечах, печах
кипящего слоя. В качестве хлоринаторов применяют хлор, хлорид водорода, хлорид
кальция, каменную соль и др. хлориды. Отходящие газы из хлоридовозгоночной печи
пропускают через аппараты горячего пылеулавливания для отделения пыли от паров
хлоридов н затем охлаждают для конденсации хлоридов металлов, к-рые улавливают
в электрофильтрах или конденсаторах (сухой способ) либо в скрубберах (мокрый
способ); свободный хлористый водород поглощают известковым молоком или
раствором хлорида кальция и возвращают в "голову" процесса.
Достоинства X.: высокое извлечение металлов, обусловленное большой хим.
активностью хлора; почти полное отделение цветных металлов от железа за одну
операцию; возможность селективной отгонки тех или иных хлоридов металлов путём
изменения состава газовой фазы; высокая степень сокращения, обеспечивающая
получение из бедного сырья богатого продукта - хлоридов, из к-рых затем
получают товарные металлы. Недостаток процесса: необходимость поддержания
высокого парциального давления, достигаемого многократным избытком хлора, к-рый
находится в обороте.
Пром. применение X. получила в произ-ве титана, бериллия, циркония и др.
редких металлов. Для получения титана брикеты из титановых шлаков с коксом при
700-800 °С продувают хлором в электрич. шахтных печах или в хлораторах для
хлорирования в расплаве. Восстановительная атмосфера обеспечивает практически
полное хлорирование окислов титана и ряда др. металлов. Легковозгоняющиеся TiCU
и SiCU конденсируются в виде жидкости, а А1С13, FeCl3,
VOCla - в виде твёрдой фазы; малолетучие хлориды кальция, магния, марганца
вместе с непрохлорированными окислами остаются в твёрдом остатке. X. начинает
применяться и для извлечения тяжёлых цветных и драгоценных металлов. Так,
пиритные огарки окатывают с хлоридом кальция и подвергают X. при 1100-1200 °С в
окислительной атмосфере. При этом возгоняют и улавливают св. 94% меди, цинка,
свинца, золота и серебра, а окислы железа, кремния, кальция и др. не
хлорируются; обожжённые окатыши направляют в чёрную металлургию. Процессы X.
разрабатываются для селективного извлечения меди, олова, висмута, свинца,
золота, серебра из сложного сульфидного сырья, для извлечения никеля, кобальта
и марганца из окисленных никелевых руд и являются перспективными для
переработки различных пром. продуктов.
Лит.: Коршунов Б. Г., С т е ф а н ю к С. Л., Введение в хлорную
металлургию редких элементов, М., 1970.
И. Д. Резник.
ХЛОРИДЫ, соединения хлора со всеми элементами, имеющими меньшее
значение электроотрицательности, т. е. со всеми металлами и неметаллами, кроме
кислорода и фтора (исключение - X. азота, к-рые принято так называть, несмотря
на то, что электроотрицательность азота больше, чем хлора).
X. металлов (или соли соляной кислоты) - твёрдые вещества,
большинство из них плавится или возгоняется без разложения. В основном X.
металлов хорошо растворимы в воде; AgCl, CuCl, HgCh, T1C1 и РЬС12 -
малорастворимы. X. щелочных и щёлочноземельных металлов имеют нейтральную
реакцию. Растворы X. др. металлов имеют кислую реакцию вследствие гидролиза,
напр.: А1С13 + ЗН20 = А1(ОН)з + 3НС1.
X. неметаллов могут быть газообразными (НС1), жидкими (РС13) или
твёрдыми (РС15). Они гидролизуются водой, напр.: РСЬ + 4Н20
= Н3Р04 + 5НС1.
X. натрия, калия, магния, кальция широко распространены в природе (см. также
Хлориды природные). О свойствах, получении и применении X. см. Алюминия
хлорид, Калия хлорид, Натрия хлорид, Магния хлорид, Кальция хлорид, Титана
галогениды и др.
ХЛОРИДЫ AЗОTA, хлорпроизводные аммиака (неорганич.
хлорамины): монохлорамин
NH2C1, дихлорамин NHC12 итрихлорамин (трёххлористый
азот)МС13. X. а. образуются при взаимодействии аммиака или солей
аммония с хлором или хлорноватистой кислотой. NH2C1 - бесцветная
маслянистая жидкость с резким запахом; tпл -60 °С. При нагревании разлагается.
NHC12 в свободном состоянии не выделен. NC13 -
ярко-жёлтая маслянистая жидкость с острым раздражающим запахом; плотность 1,653
г /см3, tпл -40 0С, tкип 71 °С. Под действием
света медленно разлагается с выделением азота и хлора. NC13
растворим в бензоле, сероуглероде, хлороформе; в воде нерастворим. Чувствителен
к удару, взрывается при соприкосновении с органич. веществами, способными
хлорироваться, напр, с каучуком, пробкой, жирами, скипидаром. X. а.
гидролизуются с образованием аммиака и хлорноватистой кислоты.
Лит. см. при ст. Хлор.
ХЛОРИДЫ ПРИРОДНЫЕ, класс минералов, солей соляной кислоты НС1. По
составу, свойствам и условиям образования выделяют две группы X. п. В первой
группе (28 минералов) растворимые водные и безводные хлориды Na, К, NH4,
Mg, Ca, A1, Мп и Fe. Гл. минералы: галит NaCl, сильвин КС1, нашатырь
NHCl, бишофит MgCl2-6H2O, карналлит KMgCl3-6H2O,
тахгидрит CaMgCLi 12Н2О, р и н н е и т NaK3FeCl6
и др. Содержат 20-70% С1. В основе кристаллич. структур лежит плотнейшая кубич.
упаковка атомов С1. Атомы металлов расположены в октаэдрич. пустотах. Хим.
связи в основном ионные. Кристаллизуются в кубич. или тригональной системах.
Обычно бесцветны; тв. по минералогич. шкале 1-2, плотность 1600-3200 кг/л3.
Гигроскопичны, хорошо растворяются в воде, частично в спирте; на вкус солёные
или горькие. Слагают зернистые и плотные массы, прожилки и желваки в осадочных
толщах; сростки кристаллов, налёты и корочки образуются в осадках озёр,
солончаках и продуктах вулканич. и фумарольной деятельности. Многие X. п.
широко используются в хим. и пищ. пром-сти, с. х-ве. См. также ст. Калийные
соли, Каменная соль.
Ко второй группе (49 минералов) относят нерастворимые хлориды Сu, Рb, Ag,
Hg, As, Sb и Bi, часто с дополнит, анионами О-, ОН-
иногда с [NO3]-, Fe~, [SO4]2+;
главные: нантокит CuCl, атакамит Cu2Cl(OH)3, коннелит Cu19Cl(OH)32SO4
- 4Н2О, лаурионит PbCl(OH), матлокит PbFCl, мендипит Рb3С12О2,
хлорарнирит AgCl, каломель Hg2Cl2, диаболеит
РbСиС12(ОН)4, б о л е и т Pb3Cu3AgCl7(OH)6
и др. Содержат 6-35% С1. Кристаллизуются в основном в ромбич. и тетрагональной
системах; нередки слоистые структуры с относительно высокой ковалентностью хим.
связей. Бесцветные, синие, зелёные, жёлтые. Образуют корочки, агрегаты
кристаллов, налёты, землистые массы. Тв. по минералогич. шкале до 4, плотность
3700-8300 кг/м3. В воде нерастворимы. Образуются в зоне
окисления рудных месторождений в условиях сухого климата; при воздействии
солёных вод на рудные минералы и пром. шлаки; в процессе вулканич.
деятельности. В составе окисленных руд используются как сырьё для получения Сu, Pb, Ag.
Лит.: Минералы. Справочник, т. 2, в 1, М., 1963.
И. В. Островская.
ХЛОРИН, торговое назв. поливинил-хлоридного волокна, выпускаемого
в СССР.
ХЛОРИРОВАНИЕ органических соединений, процесс прямого замещения в
органич. соединениях атомов водорода атомами хлора. X. может быть осуществлено
действием свободного хлора или веществами, его генерирующими, напр, хлористым
сульфурилом SO2C12 (см. Сульфурила галогениды). Механизм
X. определяется природой органич. соединения и условиями реакции. Так,
насыщенные углеводороды взаимодействуют с хлором при облучении ультрафиолетовым
светом (УФ-облучении) по радикально-цепному механизму:
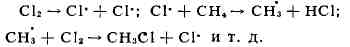
Эта реакция лежит в основе пром. способа получения из метана метил-хлорида,
метиленхлорида, хлороформа, четырёххлористого углерода, из пентановых фракций
бензина - амилхлоридов. X. органич. соединений ароматич. ряда протекает по
ионному механизму в присутствии кислотного катализатора, напр. А1С13
или FeCl3. Т. о. в пром-сти получают, напр., хлорбензол:
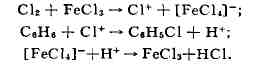
Принимая во внимание различия в механизмах X. органич. соединений алифатич.
и ароматич. рядов, регулируют X. жирно-ароматич. углеводородов: прибавление
FeCl3 ведёт к замещению атомов водорода в ароматич. ядре, тогда как
УФ-облучение и повышение темп-ры способствуют X. боковых алифатич. групп. Так,
в пром-сти X. толуола получают хлортолуолы (в присутствии FeCl3) или
бензилхлорид С6Н5СН2С1 (под действием УФ-облучения). При
высокой темп-ре удаётся осуществить прямое замещение атомов водорода на хлор и
в алкильных группах олефинов (с сохранением кратной связи), напр.:
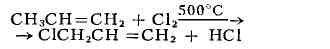
Эта реакция используется в пром-сти для получения аллилхлорида - исходного
продукта в произ-ве глицерина.
Иногда под X. в более широком смысле понимают создание связи С-С1 любым
способом, напр, присоединением по кратным связям хлора, хлористого водорода,
хлорноватистой к-ты, хлористого нитро-зила, замещением на хлор др.
функциональных групп (гидроксильной в спиртах и карбоновых в к-тах, аминогруппы
в ароматич. аминах после предварительного их диазотирования и др.). Так, в
пром-сти присоединением хлора к этилену получают дихлорэтан, являющийся
сырьём в одном из способов произ-ва винилхлорида; хлорированием
ацетилена - тетрахлорэтан, применяемый для получения трихлорэтилена, хлорированием
нек-рых каучуков - хлор-каучуки. Реакцией ненасыщенных соединений с хлористым
водородом в пром-стп производят винилхлорид, этилхлорид, хлоропрен. X.
используется также для получения инсектицидов (гексахлорана,
полихлорпинена, полихлоркамфена), гербицидов, напр. эфиров
2,4-дихлор-феноксиуксусной к-ты, гексахлорэтана (заменителя камфоры) и
др. важных продуктов.
ХЛОРИРОВАНИЕ в цветной металлург и и, технологич. процесс нагрева
материалов, содержащих цветные металлы, в атмосфере хлора, хлорсодержащих
газов или в присутствии хлористых солей с целью извлечения и разделения цветных
металлов.
В основе процесса лежит взаимодействие окислов или сульфидов металлов с хлором
или хлоридом водорода по обратимым реакциям. Окислы, у к-рых гибосова
энергия этих реакций имеет большие отрицат. значения (PbO, ZnO, Ag2O
и др.), хлорируются при малых концентрациях хлора в газовой среде и в
присутствии кислорода; окислы с большими положит, значениями гиббсовой энергии
(SiO2, TiO2, А12Оз) практически не
взаимодействуют с газообразным хлором, т. к. даже следы кислорода в газовой
среде препятствуют образованию хлоридов. X. окислов облегчается в присутствии
веществ, связывающих свободный кислород и уменьшающих его концентрацию в
газовой фазе, напр, углерода, водорода, сернистого ангидрида. Таким образом,
изменяя состав газовой фазы и темп-ру процесса, можно подобрать условия
селективного X.; в частности, в присутствии кислорода и паров воды можно
прохлорировать ряд цветных металлов, оставив в окисленной форме железо, а в
восстановит, атмосфере перевести в форму хлоридов окислы железа. В качестве
хлорирующих агентов, кроме элементарного хлора и НС1, применяют дешёвые соли -
каменную соль (NaCl), сильвинит (КСl--2NaCl), хлорид кальция (СаСl2)
и др. При этом X., в особенности при использовании малолетучего СаСl, идёт
преим. через разложение соли парами воды с образованием НСl; разложению соли-хлоринатора способствует присутствие SO2 или SiO2,
образующих CaSO, CaSiO3 и т. п.
Разновидности X.: хлорирующий обжиг, хлоридовозгонка и сегрегация.
Хлорирующий обжиг проводят при относительно низкой темп-ре, при к-рой
образующиеся хлориды ещё нелетучи. X. осуществляют в электропечах, печах кипящего
слоя, трубчатых или многоподовых обжиговых печах. Процесс применяется в
производстве магния для перевода окиси магния в хлорид, к-рый затем подвергают
электролизу, а также для извлечения кобальта и меди из бедных материалов, чаще
всего из пиритных огарков и кобальт-никелевых штейнов; кобальт, медь, цинк
переходят в форму хлоридов и выщелачиваются водой или слабой кислотой, а железо
не хлорируется и остаётся в форме окислов в твёрдом остатке. Хлоридовозгонка, в
отличие от хлорирующего обжига, ведётся при более высоких темп-pax,
обеспечивающих улетучивание хлоридов металлов; процесс более универсален:
позволяет извлекать больше различных цветных и редких металлов, а также золото
и серебро. Сегрегация, в отличие от хлоридовозгонки, требует меньшего расхода
хлоринаторов и ведётся при более низкой темп-ре, но для получения концентрата
необходима дополнит, операция - флотация или магнитная сепарация.
X. применяется также для рафинирования расплавленных металлов от примесей:
алюминия - от натрия и кальция, свинца - от цинка, олова - от свинца.
Разрабатываются процессы удаления меди и кобальта из никелевого файнштейна хлоридными
расплавами.
Лит.:
Смирнов В. И., Тихонов А. И., Обжиг медных руд и концентратов, 2 изд., М., 1966; Морозов И. С., Применение хлора в металлургии редких
и цветных металлов, М., 1966; Г у д и м а Н. В., Ш е и н Я. П., Краткий
справочник по металлургии цветных металлов, М., 1975.
И. Д. Резник.
ХЛОРИРОВАНИЕ ВОДЫ, обработка воды хлором и его соединениями. Наиболее
распространённый способ обеззараживания питьевой воды; основан на
способности свободного хлора и его соединений угнетать ферментные системы
микробов, катализирующие окислительно-восстановит. процессы. Для
обеззараживания питьевой воды применяют хлор, двуокись хлора, хлорамин (см.
Хлорамины)
и хлорную известь. Необходимая доза препарата устанавливается пробным X.
в.: она определяется хлор-поглощаемостью воды (количество хлора, необходимое
для связывания гл. обр. содержащихся в воде органич. соединений). Хлор вводят с
избытком (остаточный хлор) с целью уничтожения микробов, попадающих в воду
после её хлорирования. Содержание остаточного свободного хлора через 30 мин после
X. в. должно быть не менее 0,3 мг/л. В нек-рых случаях проводят двойное
X. в. - до очистки (предварит. X. в.) и после неё (заключит. X. в.); при
наличии в воде веществ, к-рые после X. в. могут придать ей неприятные запах и
привкус, воду до хлорирования обрабатывают аммиаком или аммонийными солями.
X. в. применяют и для обеззараживания питьевой воды в полевых условиях;
наиболее надёжен метод суперхлорирования, обеспечивающий избыток активного
хлора не менее 10 мг/л при экспозиции не менее 30 мин. Суперхлорирование
применяется и для обеззараживания воды в системах централизованного
водоснабжения при эпидемиологич. показаниях. После суперхлорирования проводится
дехлорирование - устранение избыточного хлора физ. или хим. методами.
X. в. применяют также для обеззараживания сточных вод, воды
плавательных бассейнов, обесцвечивания, обезжелезивания производственных вод и
пр.
Лит.: Руководство по гигиене водоснабжения, под ред. С. Н.
Черкинского, М., 1975.
ХЛОРИРОВАННЫЕ ПОЛИОЛЕФИНЫ, синтетич. полимеры, продукты хлорирования
полиэтилена (в СССР наз. ХПЭ) и полипропилена (ХПП). X. п. отличаются
разнообразием свойств, зависящих от типа, мол. массы и строения исходного
полимера, а также от способа введения хлора и его количества. Напр., ХПЭ,
содержащий до 15% хлора, - пластик; 16-25% - термоэластопласт; 26-48% -
эластомер (каучук); 49-60% -жёсткий кожеподобный материал; 61-75% - хрупкая
смола. ХПЭ, содержащий 61-70% хлора, приближается по свойствам к
поливинилхлориду. Плотность ХПЭ 0,92-1,61 г/см3. Прочность
при растяжении высокохлорированных ХПЭ и ХПП достигает соответственно 25 и 32 Мн/м2
(250 и 320 кгс/см2). Ценные свойства X. п. - хорошая
адгезия к различным поверхностям и огнестойкость. ХПЭ стоек также к действию
озона, кислорода, щелочей, растворов солей, сильных к-т, алифатич.
углеводородов, спиртов, масел, бензина, менее стоек к хлорированным ароматич.
углеводородам. При действии света и тепла X. п. могут отщеплять НС1 и поэтому
требуют стабилизации (см. Стабилизаторы полимерных материалов). Из
ХПЭ-пластика изготовляют, напр., прозрачные пленки мед., бытового и с.-х.
назначения. ХПЭ-эластомер применяют в произ-ве резинотехнич. изделий; в смеси
с поливинилхлоридом - для получения огне- и морозостойких пластмасс. ХПП
перерабатывают в волокна и прозрачные прочные плёнки. ХПЭ и ХПП, содержащие
50-70% хлора, служат связующими лакокрасочных материалов, а также основой клеевых
композиций и покрытий различного назначения. Зарубежные торг. назв. полимеров
типа ХПЭ: тирин (США), галофлекс (Великобритания), хлорхостален (ФРГ), эласлен
(Япония); полимеров типа ХПП - перлон Р (США). Мировое произ-во (1976) ок. 80
тыс. т.
Лит.:
Энциклопедия полимеров, т. 3, М., 1977.
Г.М. Ронкин.
ХЛОРИСТАЯ КИСЛОТА, НСlО2, одноосновная к-та, в к-рой
хлор имеет степень окисления +3; существует только в разбавленных водных
растворах. Константа диссоциации 1,1 - 10~2 (18°С). Получается при
растворении в воде двуокиси хлора: 2СlO2 + Н2О= НС102
+ НСlO3. В промышленности используются соли X. к. - хлориты, в основном
NaClO2.
Лит. см. при ст. Хлор.
ХЛОРИСТОВОДОРОДНАЯ КИСЛОТА, то же, что соляная кислота.
ХЛОРИСТЫЙ ВОДОРОД, НСl, при обычных условиях бесцветный газ с резким
запахом; на воздухе при поглощении влаги образует туман, представляющий собой
мельчайшие капельки соляной кислоты. Масса 1 л X. в. при 0 0С
и 0,1 Мн/м2 (1 кгс/см2) 1,6391
г; плотность
по воздуху 1,268; плотность жидкого X. в. при -60° С1,12г/см3; tпл - 114,2°С;
tкип - 85,1°С. Критич. константы: температура 51.4°С; давление 8,45 Мн/м2
(84,5 кгс/см2); плотность 0,42 г/см3;
удельный объём 2380 см3/г. X. в. растворяется в воде с выделением
тепла; при этом образуется соляная к-та. Под давлением 0,1 Мн/м2 (1
кгс/см2) 1 л воды растворяет 500 л НС1 при 2°С, 442 л
при 20°С, 339 л при 60°С.
X. в.- стойкое соединение; при 1800°С он диссоциирует на Сl2 и Н2
только в незначит. степени. Химически в отсутствие Н2О X. в.
малоактивен, в газообразном виде не реагирует с углеродом, фосфором, серой,
железом. При нагревании с кислородом до 400-500°С в присутствии катализатора
СиС12 X. в. окисляется до хлора: 4НС1 + О2 = 2Н2О
+ 2С12. Со щелочными металлами, алюминием и магнием реагирует с
выделением водорода, особенно легко при нагревании, напр.: 2А1 + 6НСl = 2АlСlз
+ 3Н2. С аммиаком взаимодействует с образованием дыма - твёрдых
частиц хлорида аммония NH4Cl. В присутствии катализаторов
присоединяется к ненасыщенным органич. соединениям, напр.: С2Н4
+ + НСl->С2Н5Сl.
Получают X. в. прямым синтезом из элементов или действием серной к-ты на
хлорид натрия. Большие количества X. в. получаются как побочный продукт при хлорировании
органич. соединений: RH + Cl2 = RCl + HCl (где R - радикал), а
также при гидролизе хлорида магния: MgCl2 + H2O= MgO +
2HCl. Мировое произ-во X. в. составляет ок. 10 млн. т (1975).
X. в. используют для получения соляной кислоты, синтеза органич. соединений,
напр., винилхлорида.
Лит.: Якименко Л. М., Производство хлора, каустической соды и
неорганических хлорпродуктов, М., 1974; Якименко Л. М., Пасманик М. И.,
Справочник по производству хлора, каустической соды и основных хлорпродуктов,
2 изд., М., 1976.
Л. М. Якименко.
ХЛОРИСТЫЙ КАЛИЙ, концентрированное калийное удобрение. Белое
кристаллич. вещество, гигроскопично, слёживается при хранении, хорошо
растворяется в воде. Содержит калия хлорид и примеси; калия в пересчёте
на К2О -52-60%. Применяют X. к. на всех почвах как осн. удобрение -
осенью под зяблевую вспашку и в пару. При систематич. внесении подкисляет почву
(физиологически кислое удобрение). Особенно эффективно при использовании под
корнеплоды, картофель, подсолнечник, плодовые и др. калиелюбивые культуры.
ХЛОРИСТЫЙ ЦИАН, ClCN, при обычных условиях бесцветный газ; tпл -6°С,
tкип 13°С. X. ц. в присутствии галоген-водородных к-т тримеризуется, образуя цианурхлорид.
Получают X. ц. действием хлора на водный раствор Na2[Zn(CN)4];
может быть получен также взаимодействием хлора с водным раствором HCN.
Используется для получения цианамида (сырья в произ-ве дициандиамида и
меламина)
и нек-рых красителей. Токсичен (незначительные количества его в воздухе
рабочих помещений вызывают слезотечение).
Лит. см. при ст. Хлор.
ХЛОРИТИЗАЦИЯ, метасоматич. процесс, при к-ром темноцветные минералы
горных пород, а иногда и осн. масса породы замещаются Хлоритами. Различают:
региональную постмагматич. X. осн. эффузивов и их туфов (см. Зелено-каменные
породы); X. основных лав, сопряжённую с альбитизацией (см. Спилиты), а
также темноцветных минералов кислых и средних изверженных пород (напр., биотита
и роговой обманки в гранитоидах); гидротермальную X. разнообразных пород как
распространённый тип околорудных изменений (см. Пропилитизация). Развитие
линейных зон X. является поисковым признаком гидротермальных рудных
месторождений.
ХЛОРИТОИД [от хлориты (минералы) и греч. eidos - вид], минерал
класса островных силикатов, химический состав (Fe, Mg)2 (Al,Fe3+)Al3[SiO4]2O2(OH)4.
Содержит до 16,6% МnО в оттрелите. Кристаллизуется в моноклинной и триклинной
системе; обе модификации одинаково распространены и часто образуют тесные
срастания. Обычно наблюдается в виде плохообразованных таблитчатых кристаллов
и их сростков (порфиробласты X. в метаморфич. сланцах), а также чешуйчатых
агрегатов. Цвет тёмно-синий, тёмно-зелёный (до чёрного). Тв. по минералогич.
шкале 6,5; плотность ок. 3600 кг/м3. Хрупок. Характерна
совершенная спайность параллельно уплощению кристаллов. Породообразующий
минерал нек-рых метаморфич. сланцев и контактных роговиков; встречается также в
месторождениях наждака, в гидротермальных кварцевых жилах и околожильных
породах.
ХЛОРИТЫ, соли хлористой кислоты НСlО2. Образуются
при взаимодействии двуокиси хлора с растворами щелочей в присутствии Н2О2
или восстановителей, напр.:
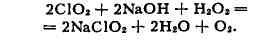
X. в кислой среде - хорошие окислители, в твёрдом состоянии легко взрываются
от удара, а также при нагревании или в присутствии легкоокисляющихся примесей.
Из X. применение находит X. натрия. Это бесцветные кристаллы. Растворимость
в воде (в %): 31,1 (0°С); 50,7 (37,4°С); 56,3 (70°С); ниже 37,4°С образует
кристаллогидрат NaClO2-3H2O. Выше 100°С X. натрия
начинает разлагаться с образованием натрия хлората и натрия хлорида. При
взаимодействии с хлором X. натрия образует СlО2 и NaCl. Используется
в виде водных растворов для мягкой отбелки тканей (гл. обр. льняных) и бумаги,
для обеззараживания воды, в небольших количествах - для получения С1О2.
Лит. см. при ст. Хлор.
ХЛОРИТЫ (от греч. chloros - зелёный), группа широко распространённых
минералов - водных метаалюмосиликатов Mg и Fe со слоистой слюдоподобной
кристаллич. структурой. Хим. состав (Mg, Fe2+)-[AlSi3O10(OH)2]-3(Mg,
Fe)(OH)2; характерны изоморфные замещения Si на Аl в пределах Si7Al3
- Si4Al4, Mg на Аl в пределах MguAl - Mg4AU; Mg2+
может полностью замещаться на Fe2+ и Fe3+, частично также
на Мn2+,Сr, Ni, Ti, Li и др. Различают триоктаэдрич. и диоктаэдрич.
X., а также X. с частично или полностью неупорядоченными структурами. Слоистая
кристаллич. структура X. определяет широкое распространение полиморфных
модификаций (политипов). Часто возникают смешанно-слойные образования типа
хлорит-монтмориллонит, хлорит-вермикулит (корренсит) и др. По соотношению Fe2+/Fe3+
выделяются ортохлориты (неокисленные, с содержанием Fe2O3
не более 4%) и лептохлориты (окисленные, богатые Fe2O3).
Ортохлориты - большая группа минералов, различающихся по общей же-лезистости,
т. е. величине отношения Fe/(Fe + Mg) в октаэдрич. слоях и по соотношению Si/Al
в тетраэдрах. Среди ортохлоритов выделяются: магнезиальные (по возрастающему
количеству Si) - корундофиллит, шериданит, клинохлор, пеннин, тальк-хлорит;
магнезиально-железистые - рипидолит, пикнохлорит, диабантин; железистые -
псевдотюрингит, дафнит, брунсвигит. К лептохлоритам относятся тюрингит,
шамозит, делессит. Известны также X. марганцовистые - пеннантит и
гоньерит, хромовые - кеммерерит и кочубеит, литиевые - кукеит и др.
Точная диагностика X. возможна с помощью рентгеноструктурного,
электронографич. и термич. анализов. X. кристаллизуются в моноклинной или
триклинной системах, характеризуются слюдоподобным пластинчатым
псевдогексагональным габитусом кристаллов, совершенной спайностью, низкой
твёрдостью (1,5-2,5); пластинки X. гибки, но не упруги; плотность 2600-3300 кг/м3.
Образуют пластинчатые, чешуйчатые, сферолитовые, скрытокристаллич.
оолитовые агрегаты. Цвет обычно зелёный (от светло- до тёмно-зелёного), но
встречаются белые, жёлтые (маложелезистые), розовые, красно-фиолетовые
(содержащие Сг и Мn), чёрные (Fe-хлорит) разности.
Ортохлориты - важные породообразующие минералы зелёных сланцев - пород
начальных стадий регионального метаморфизма; характерны для околорудноизмененных пород гидротермальных месторождений и преобразованных лав
вулканич. областей. Процессы хлоритизации широко развиты в природе и протекают
при сравнительно невысоких темп-pax (см. также Зеленокаменные породы,
Пропилитизация). X. часто возникают как продукты изменения более
высокотемпературных Mg-Fe-силикатов (биотита, амфиболов и др.), а также
замещают скаполиты, плагиоклазы, гранаты, везувиан, ставролит и мн. др.
минералы с образованием по ним псевдоморфоз. В больших количествах X.
(совм. с тальком и серпентином) появляются при гидротермальном
преобразовании ультраосновных горных пород, вулканич. туфов, глинистых сланцев,
иногда даже доломитов. Часто присутствуют в рудных кварцевых жилах и
околожильных ореолах. Литиевые X. встречаются в редкометальных пегматитах, хромовые
- в месторождениях хромитов, никелевые - образуются при изменении нек-рых
основных изверженных пород. Лептохлориты (тюрингит и шамозит) имеют преим.
осадочное происхождение, иногда они образуют крупные залежи пром. значения
(напр., жел. руды на Урале, в Тюрингии, Лотарингии).
Лит.: Сердюченко Д.
П., Хлориты, их химическая конституция и классификация, М.. 1953 (Тр. Ин-та
геологич. наук АН СССР, в. 140); Кепежинскас К. Б., Статистический анализ
хлоритов и их параге-нетические типы, М., 1965; Дир У. А., X а у и Р. А., 3 у с
м а н Дж., Породообразующие минералы, т. 3. Листовые силикаты, пер. с англ.,
М., 1966; К о с т о в И., Минералогия, пер. с англ., М., 1971; Годовиков А. А.,
Минералогия, М., 1975.
А. М. Портнов, Л. Г. Фельдман.
ХЛОР-ИФК, 3-Сl С6H4NHСООС3H7-изо, хим. препарат преим. для борьбы с
однолетними злаковыми сорняками хлопчатника, лука, моркови, подсолнечника, сои,
гороха (гербицид).
ХЛОРНАЯ ВОДА, раствор хлора в воде. Получают в хлораторе пропусканием
хлора в воду до насыщения (1 объём воды растворяет при 20°С ок. 2,2 объёма
газообразного хлора). При охлаждении X. в. из неё выпадает гидрат хлора -
соединение переменного состава Сl2-иН2О (где п
= 6-f- 8)-жёлтые кристаллы, плавящиеся с разложением при 9,6°С. При обычной
темп-ре до 50% растворённого в X. в. хлора подвергается гидролизу: Cl2
+ H2O->-<-2HClO + HCl; образующаяся HС1О разлагается на свету
на О2 и НС1. X. в. - сильный окислитель, применяется для
обеззараживания вод и отбелки тканей.
Лит. см. при ст. Хлор.
ХЛОРНАЯ ИЗВЕСТЬ, белильная известь, сложный комплекс гипохлорита
Са(С1О)2, хлорида СаСl2, гашёной извести Са(ОН)2
и кристаллизационной воды. Белый гигроскопичный порошок с запахом хлора.
Насыпная масса ок. 500 кг/м3. Товарная X. и. близка к составу
1,5Са(С1О)2-1,5СаС12-3Са(ОН)2-nН2О
и содержит от 28 до 38% активного хлора (т. е. хлора, выделяющегося при реакции
извести с соляной к-той) и ок. 10% воды. Получается при взаимодействии
газообразного хлора с гашёной известью Са(ОН)2. X. и. при хранении
медленно разлагается, теряя в год ок. 10% активного хлора; на воздухе при
поглощении влаги и углекислого газа разложение ускоряется. В присутствии
органич. примесей или каталитически действующих солей нек-рых металлов (Fe, Ni,
Co), а также при нагревании X. и. разлагается бурно. Сильный окислитель.
Выпускается также стабильная X. и., содержащая 2% воды (потеря активного
хлора 7-9% за 8 лет); её получают хлорированием гашёной извести в кипящем слое
при повышенной темп-ре. X. и. - сильный окислитель. Применяется в медицине в
качестве антисептического средства, для дезинфекции помещений, посуды, а
также для хлорирования воды, обеззараживания отбросов. В ограниченном
количестве X. и. используется для отбеливания целлюлозы и тканей, хлорирования.
Лит. см. при ст. Хлор.
ХЛОРНАЯ КИСЛОТА, НСlО4, одноосновная кислота, в которой
хлор имеет степень окисления +7. Безводная X. к. - бесцветная подвижная жидкость,
дымящая на воздухе, плотность при 20°С 1,761 г/см3; tкип
-102°С, tкип = 110 °С. X. к. - одна из самых сильных неорганич. к-т;
соответствующие ей соли - перхлораты. Безводная X. к. очень
реакционноспособна и неустойчива. С водой образует ряд гидратов НСlО4-nН2О
(где п = 0,25-:- 4). Водные растворы X. к. устойчивы, имеют низкую окислит,
способность. X. к. с водой образует азеотропную смесь, кипящую при 203 °С и
содержащую 72% НСlО4.
Водные растворы X. к. получают электрохим. окислением соляной к-ты или
хлора, растворённых в крепкой X. к., а также обменным разложением перхлоратов
натрия или калия сильными неорганич. к-тами. Концентрированные водные растворы
X. к. широко используются в аналнтич. химии, а также для получения перхлоратов.
Безводная X. к. получается при взаимодействии перхлоратов натрия или калия с
крепкой серной к-той, а также водных растворов X. к. с олеумом. Безводную
X. к. нельзя длительно хранить и перевозить, т. к. при хранении в обычных
условиях она медленно разлагается, окрашивается окислами хлора, образующимися
при её разложении, и может самопроизвольно взрываться. X. к. применяется при
разложении сложных руд, при анализе минералов, а также в качестве катализатора.
Лит.: Росоловский В. Я., Химия безводной хлорной кислоты, М., 1966;
Якименко Л. М., Производство хлора, каустической соды п неорганических
хлорпродуктов, М., 1974; Якименко Л. М., Пасманик М. И., Справочник по
производству хлора, каустической соды и основных хлорпродуктов, 2 изд., М.,
1976.
Л. М. Якименко.
ХЛОРНОВАТАЯ КИСЛОТА, НСlO3, сильная одноосновная к-та, в к-рой хлор
имеет степень окисления +5. В свободном виде не получена; в водных растворах
при концентрации ниже 30% на холоду довольно устойчива; в более
концентрированных растворах распадается: 8НСlО3 = 4НС1О4 + ЗО2 + 2С12
+ 2Н2О. X. к. - сильный окислитель; окислительная способность увеличивается
с возрастанием концентрации и темп-ры. В 40%-ной X. к. воспламеняется, напр.,
фильтровальная бумага. X. к. образуется при разложении хлорноватистой
кислоты, при электролизе растворов хлоридов; в лабораторных условиях
получают при взаимодействии хлората бария с разбавленной серной к-той: Ва(СlO3)2+
+ H2SO4= BaSO4 + 2HClО3. X. к. соответствуют
соли - хлораты; из них наибольшее значение имеют хлораты натрия, калия,
кальция и магния.
Лит. см. при ст. Хлор.
ХЛОРНОВАТИСТАЯ КИСЛОТА, НСlO, очень слабая одноосновная к-та, в к-рой
хлор имеет степень окисления +1. Неустойчива, постепенно разлагается даже в
разбавленных водных растворах. X. к. и её соли - гипохлориты - сильные
окислители. Кристаллогидрат LiClO - Н2О выдерживает
длительное хранение; NaClO-H2O при 70 °С разлагается со взрывом, а
КСlО известен только в виде водных растворов. Са(СlО)2 в сухом виде
вполне устойчив, но в присутствии Н2О и СО2 разлагается.
Более стоек Mg(ClO)2. X. к. и гипохлориты легко разлагаются с
выделением кислорода и поэтому широко используются для отбелки целлюлозы и
тканей, а также для санитарных целей. X. к. получается при гидролизе хлора или
при растворении окиси хлора Сl2О в воде. В пром. масштабе
производятся гипохлориты кальция, натрия, калия, лития хлорированием известкового
молока и соответствующих щелочей.
Лит. см. при ст. Хлор.
ХЛОРОБАКТЕРИИ, то же, что зелёные бактерии.
ХЛОРОГЕНОВАЯ КИСЛОТА, C16H18O9,
сложный эфир кофейной (3,4-диоксикоричной) к-ты с одним из стереоизомеров хинной
кислоты. Бесцветные кристаллы с tпл 206-210 °С, хорошо растворимы в воде.
Щелочные растворы X. к. на воздухе зеленеют (отсюда назв.). Широко
распространена среди высших растений, часто в смеси с изомерной ей
изохлорогеновой к-той. В больших кол-вах содержится в прорастающих семенах подсолнечника
и необжаренных зёрнах кофе. Вероятно, X. к. принимает участие в регулировании
созревания плодов, воздействуя на дыхание плодов как ингибитор окислительного
фосфорилирования. X. к. токсична для нек-рых патогенных микроорганизмов,
вызывающих болезни растений (паршу картофеля, вилт и т. п.). У ряда растений
(напр., у риса) биосинтез X. к. увеличивается в ответ на микробную инфекцию.
ХЛОРОЗ (от греч. chloros - бледно-зелёный, зеленовато-жёлтый),
устаревшее назв. железодефицитной анемии, преим. у лиц юношеского возраста.
ХЛОРОЗ РАСТЕНИЙ, болезнь растений, при к-рой нарушается образование
хлорофилла в листьях и снижается активность фотосинтеза. Характерные признаки:
преждевременное пожелтение и опадение листьев, мелколистность, усыхание
верхушек побегов, отмирание активных корней и т. п. Из культурных растений чаще
болеют плодово-ягодные и декоративные культуры. Причины X. р. различны.
Инфекционный X. р. вызывается вирусами (напр., верхушечный хлороз табака и
махорки, хлороз малины), грибами и др. микроорганизмами. Переносчиками его
возбудителей часто являются вредители (трипсы, тли). Не инфекционный, или
функциональный, X. р. возникает при неблагоприятных почвенных и климатич.
условиях и нарушениях технологии возделывания с.-х. культур. В большинстве случаев
это железный или известковый X. р., к-рым болеют плодово-ягодные культуры,
особенно виноград, на карбонатных почвах. Встречается также цинковый, магниевый
X. р. и др. При заболевании происходит своеобразное пожелтение листьев:
появляются пятна, сначала желтеют нижние или верхние листья или только
межжилковые участки (см. Диагностика питания растений). Наследственный
X. р. (пестролистность, золотолистность) возникает как мутация и передаётся по
наследству. Используется в селекции декоративных растений для выведения
пестролистных форм.
Меры борьбы: для предупреждения X. р. применяют органич. и минеральные
удобрения, проводят кислование карбонатных почв, мульчирование и задернение
междурядий садов, уничтожают вредителей - переносчиков инфекции. При лечении
неинфекционного X. р. в почву вносят недостающие элементы питания вблизи
активной зоны корневой системы, используют некорневые подкормки и инъекции
растворами микроудобрений в штамбы, ветки и корни плодовых деревьев; растения,
заболевшие инфекционным хлорозом, удаляют.
Лит.: Дементьева М. И., Болезни плодовых культур, М., 1962; Ш п о т а
Л. А., Хлороз растений в Чуйской долине и борьба с ним, Фр., 1968; Накаидзе И.
А., Почвенные условия и хлороз виноградной лозы в Грузии, Тб., 1969.
Л. А.
Шпота.
ХЛОРОКИСЬ МЕДИ, 3Cu(OH)2-CuCl-Н2О, хим.
препарат для борьбы с возбудителями болезней (церкоспороз сахарной свёклы,
фитофтороз картофеля, септориоз, фитофтороз томата, парша и монилиоз яблони и
груши, милдью винограда и др.) растений (фунгицид).
ХЛОРОКОККОВЫЕ ВОДОРОСЛИ, класс (или порядок) зеленых водорослей.
ХЛОРОКРУОРИНЫ (от греч. chloros -бледно-зелёный и лат. сruоr -
кровь), зелёные дыхательные пигменты, заменяющие гемоглобины у нек-рых представителей
многощетинковых червей (семейства Sabellidae, Serpulidae, Chlorhaemidae,
Ampharetidae). В крови нек-рых из этих червей встречаются одновременно X. и
гемоглобины. У молодых особей рода Serpula преобладают гемоглобины, у взрослых
- X. Выделенная из сосудов кровь, содержащая X., красного цвета, разбавленная -
зелёного. По хим. строению X. отличаются от гемоглобинов в белковой и
небелковой частях молекулы. X. содержат гем, в к-ром винильная группа
(СН = СН) протопорфирина (см. Порфирины) в положении 2 замещена
формпльной группой (СНО). В плазме крови X. находятся в растворённом состоянии
и, подобно эритрокруорину, имеют высокую мол. м. (2800000). У X. и
гемоглобинов одинаковое сродство к кислороду.
Лит.: Гауровиц Ф., Химия и функции белков, пер. с англ., М.,
1965; Сравнительная физиология животных, т. 2, пер. с англ., М., 1977, гл. 8.
Е.
П. Феденко.
ХЛОРОПЛАСТЫ (от греч. chloros - зелёный и plastos - вылепленный,
образованный), внутриклеточные орга-неллы растительной клетки - пластиды, в к-рых
осуществляется фотосинтез. Окрашены в зелёный цвет благодаря присутствию в них
осн. пигмента фотосинтеза - хлорофилла. Осн. функция X., состоящая в
улавливании и преобразовании световой энергии, нашла отражение и в особенностях
их строения. У высших растений X. - тельца линзообразной формы диаметром 3-10 мкм
и толщиной 2-5 мкм, представляют собой систему бел-ково-липидных
мембран, погружённых в основное вещество - матрикс, или стро-му, и отграничены
от цитоплазмы наружной мембраной (оболочкой). Внутр. мембраны образуют единую
(непрерывную) пластинчатую, или ламеллярную, систему, состоящую из замкнутых
уплощенных мешочков (цистерн) - т. н. ти-лакоидов, к-рые группируются по 10-30
(стопками) в граны (до 150 в X.), соединяющиеся между собой крупными тилакоидами.
При таком строении значительно увеличивается фотоактивная поверхность X. и
обеспечивается максимальное использование световой энергии. В мембране
тилакоидов, состоящей из двух слоев белка, разделённых слоем липидов,
осуществляется первичная световая стадия фотосинтеза, ведущая к образованию
двух необходимых для ассимиляции СО2 соединений - восстановленного никотинамид-адениндинуклеотидфосфата
(НАД Н) и богатого энергией соединения аденозин-трифосфата (АТФ).
Источником энергии для образования молекул АТФ является разность потенциалов,
к-рая образуется на мембране в результате векторного (направленного) переноса
заряда. Разделение заряда по обеим сторонам мембраны обеспечивается особым
расположением компонентов электронно-транспортной цепи в мембране, перешнуровывающих
со толщу. Благодаря мембранам, играющим роль "перегородок",
осуществляется пространственное разобщение продуктов фотосинтеза, напр. О2
и восстановителей, без к-рых эти продукты взаимодействовали бы друг с
другом. Наружная поверхность тилакоида покрыта частицами диаметром 14-15 нм,
к-рые представляют собой "факторы сопряжения", участвуют в
синтезе АТФ. В строме же сосредоточены ферменты фиксации СО2
(темновая стадия фотосинтеза). У растений, способных к
"кооперативному" фотосинтезу, существует 2 типа X., различающихся по
строению и функциям. Одни из них, находящиеся в клетках мезофилла, мелкие с
гранами, другие, более крупные, содержатся в клетках обкладки проводящих
сосудистых пучков, граны в них лишь зачаточные или совсем отсутствуют. В X. второго
типа функционирует фотосистема 1, к-рая образует АТФ в ходе циклич.
фосфорилирования, а НАДФ - Н - за счёт реакции декарбоксилирования
яблочной к-ты. X. клеток обкладки фиксируют СО2 на
рибулозо-дифосфате, т. е. с помощью цикла Калвина, а X. клеток мезофилла - на
фосфоенолпирувате (путь Хетча-Слэка); т. о. взаимодействие X. обоих типов
обеспечивает высокую эффективность фотосинтеза у растений. В строму X., наряду
с ферментами фиксации СО2, включены нити ДНК, рибосомы, крахмальные
зёрна, осмиофильные гранулы.
Модель пластинчатой (ламеллярной) системы хлоропластов. Столбики - граны,
образованные тилакоидами.
Наличие в X. собственного генетич. аппарата и специфич. белоксинтезирующей
системы обусловливает определённую, хотя и относительную, автономию X. в
клетке. При развитии и размножении растения в новых генерациях клеток X.
возникают только путём деления. Происхождение X. связывают с симбиогенезом,
полагая, что совр. X. - потомки синезелёных водорослей, вступившие в
симбиоз с древними ядерными гетеротрофными клетками бесцветных водорослей или
простейших.
X. занимают 20-30% объёма растит. клетки. У водорослей, напр., хламидомонады,
имеется один X., в клетке высших растений содержится от 10 до 70 X. Развиваются
X. из т. н. инициальных частиц, или пропластид, - небольших пузырьков,
отделяющихся от ядра. В конце вегетации растения X. в результате разрушения
хлорофилла утрачивают зелёную окраску и превращаются в хромопласты. См.
также Фотосинтез.
Лит.: Хлоропласты и митохондрии. Вопросы мембранной биологии, Сб.,
М., 1969; Л ё в и А., С и к е в и ц Ф., Структура и функция клетки, пер. с
англ., М., 1971; Хит О., Фотосинтез, пер. с англ., М., 1972; Баславская С. С.,
Фотосинтез, М., 1974; Н а с ы р о в Ю. С., Фотосинтез и генетика хлоропластов,
М., 1975; Structure and function of chloroplasts, ed. M. Gibbs, В., 1971.
P. М.Бекина.
ХЛОРОПРЕН, 2-хлорбутадиен-1,3, CH2 = CH-CC1 = CH2,
бесцветная жидкость с резким запахом; tкип 59,4 °С, плотность 0,9585
г/см3 (20 °С). Нерастворим в воде, смешивается с большинством
органич. растворителей. X. присоединяет по двойным связям (обычно в положение
1,4) галогены, галогеноводороды, вступает в реакции диенового синтеза, чрезвычайно
легко полимеризуется (поэтому его стабилизируют добавками пирогаллола или
пирокатехина). Получают X. гидрохлорированием винилацетилена при
0-20 "С в присутствии хлорида меди Сu2Сl2 и хлорида
аммония; применяется для произ-ва хлоропреновых каучуков. Токсичен; предельно
допустимая концентрация в воздухе 0,002 мг/л.
ХЛОРОПРЕНОВЫЕ КАУЧУКИ, синтетич. каучуки, полимеры хлоропрена общей
формулы [-СН3-ССl = СН--СН2-]n; продукты светло-жёлтого
цвета. Плотность X. к. 1,20-1,24 г/см3, мол. м. (100-200)-103,
темп-pa стеклования -40° С, удельное объёмное электрич. сопротивление 4,4-106
ом-м, электрич. прочность 23 Мв/м, диэлектрич. проницаемость
6,4-6,7. Для X. к. характерен комплекс специфич. свойств, обусловленных
присутствием в их макромолекулах атомов хлора: масло-, бензо-, озоно- и
теплостойкость, негорючесть, а также способность к вулканизации окислами
металлов (в пром-сти для этой цели применяют смеси ZnO и MgO). X. к.
кристаллизуются при растяжении, благодаря чему ненаполненные резины на их
основе имеют высокую прочность. При наполнении X. к. этот показатель резин в
нек-рых случаях снижается (см. Резина), однако др. их ценные свойства,
напр., сопротивление раздиру, бензостойкость, как правило, улучшаются.
Пром. метод синтеза X. к. - полимеризация в водной эмульсии. Осн. области их
применения - произ-во резинотехнич. изделий, гл. обр. конвейерных лент,
ремней, рукавов. Из X. к. изготовляют также оболочки проводов и кабелей,
защитные покрытия. Важное пром. значение имеют клеи из X. к. и
хлоропреновые латексы. Мировое произ-во X. к. ~ 400 тыс. т в
год. Наиболее распространённые торг. назв. - н а и р и т (СССР), н е о п р е н
(США).
Лит.: Энциклопедия полимеров, т. 3, М., 1977; см. также лит. при ст. Каучуки
синтетические.
ХЛОРОФИЛЛ (от греч. chloros - зелёный и phyllon - лист), зелёный
пигмент растений, с помощью к-рого они улавливают энергию солнечного света и
осуществляют фотосинтез. Локализован в особых клеточных структурах
-хлоропластах или хроматофорах и связан с белками и липидами мембран.
Основу структуры молекулы X. составляет магниевый комплекс порфиринового цикла;
в IV пиррольном кольце к остатку пропионовой к-ты присоединён
высокомолекулярный спирт фитол, к-рый придаёт X. способность
встраиваться в ли-
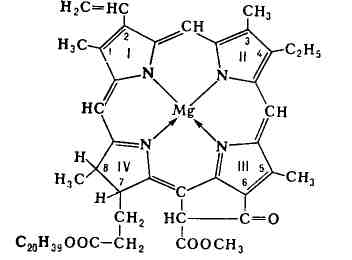
пидный слой мембран хлоропластов. Высшие растения и зелёные водоросли
содержат X. а и в, бурые и диатомовые водоросли - a и с, красные водоросли - X. а
и d. В фотосинтезирующих бактериях присутствуют близкие аналоги X. -
бактериохлорофиллы. По своему строению X. близок к др. природным
комплексам порфиринов (с железом) - дыхательным пигментам - цитохромам, красящему
веществу крови - гему, а также простетич. группам нек-рых ферментов -
пероксидазы, каталазы.
Назв. "X." было дано франц. химиками П. Пельтье и Ж. Каванту
зелёному спиртовому раствору смеси растит, пигментов в 1817. Впервые X. а и в
разделил в начале 20 в. рус. учёный М. С. Цвет с помощью разработанного
им хроматографич. метода. Хим. структуру X. выяснили нем. учёные Р. Вилыитеттер,
А. Штоль (1913), X. Фишер (1930-40). Полный синтез X. осуществил амер.
химик Р. Вудворд. Роль X. в фотосинтезе доказана классич. работами К. А.
Тимирязева. Пути биосинтеза X. выяснены в трудах амер. учёных Д. Шемина,
С. Граника и др.; большой вклад в изучение X. внесли сов. учёные Т. Н. Годнее и
А. А. Шлык.
Осн. путь биосинтеза X. определяется конденсацией двух молекул
б-амино-левулиновой к-ты с образованием порфооилиногена - производного
пиррола, к-рый в результате ряда ферментативных превращений даёт соединение,
содержащее порфириновое ядро - протопорфирин IX. Из протопорфирина образуется
непосредственный предшественник X. - протохлорофиллид, уже содержащий атом
магния. Путём последующих реакций восстановления и присоединения фитола из
этого предшественника образуется X. Стадия восстановления протохлорофиллида
осуществляется у высших растений на свету, у низших растений - в темноте.
В хлоропластах и хроматофорах большая часть X. (содержание его обычно
составляет 0,5-1,5% на сухую массу) находится в виде светособирающей "антенны"
и меньшая часть - в реакционных центрах, непосредственно участвующих в работе
цепи фотосинтетич. переноса электрона. Поглощая квант света, молекула X.
переходит в возбуждённое состояние (длительность жизни синглетного
возбуждённого состояния ок. 10-9 сек), к-рое может переходить
в долгоживущее триплетное возбуждённое состояние с длительностью жизни до 10-3
сек. Возбуждённые светом молекулы X. способны переносить электрон от
молекулы-донора к молекуле-акцептору. Механизм этих реакций в модельных системах
выяснен в работах сов. учёных А. А. Красновского, В. Б. Евстигнеева и др.
Способность возбуждённого X. к переносу электрона обеспечивает функционирование
реакционных центров фотосистем цепи фотосинтетич. переноса электрона.
Применение спектральной техники и низких темп-р показало, что в первичном
фотоакте бактериохлорофилл, а возможно, и X. активного центра отдают свой
электрон молекуле-акцептору (убихинон, ферредоксин). Этот первичный фотопроцесс
сопряжён с цепью энзиматич. реакций, ведущих к образованию восстановленных
пиридиннук-леотидов и аденозинтрифосфата, обеспечивающих работу углеродного
цикла. Т. о., свет, поглощённый X., преобразуется в потенциальную хим. энергию
органич. продуктов фотосинтеза и молекулярного кислорода. Свет, поглощаемый X.,
вызывает в клетках также др. фотобиологич. явления: индуцирует генерацию
электрич. потенциала на мембранах хлоропластов, влияет на движение
одноклеточных организмов (фототаксис) и т. д.
Исследованию свойств X. на разных уровнях молекулярной организации уделяется
большое внимание, т. к. эти свойства тесно связаны с фундаментальным явлением
преобразования энергии света в хим. энергию при фотосинтезе.
Лит.: Тимирязев К. А., Солнце, жизнь и хлорофилл, Избр. соч., т. 1,
М., 1948; Годнев Т. Н., Строение хлорофилла и методы его количественного
определения, Минск, 1952; Хлорофилл. Сб. ст., Минск, 1974; К р а с н о в с к и
й А. А., Преобразование энергии света при фотосинтезе. Молекулярные механизмы,
М., 1974 (Баховские чтения, 29); Vernon L. P., S е е 1 у G. R., The
chlorophylls, N. Y._ L., 1966.
А. А. Красновский.
ХЛОРОФИТУМ (Chlorophytum), род растений сем. лилейных. Многолетние
травы с укороченным стеблем и утолщёнными, иногда клубневидными корнями. Листья
лилейные, ланцетовидные или овальные, в прикорневой розетке. Цветки 3-членные,
белые, мелкие, невзрачные, в кистях. Плод - трёхгранная коробочка. У нек-рых
видов на цветоносе образуются вегетативные почки, из к-рых развиваются дочерние
растения. К таким видам относятся X. хохлатый (Ch. comosum) - комнатное ампельное
растение; в культуре известны также его формы с белыми полосками на
листьях.
ХЛОРОФОРМ, трихлорметан, СНСl3, бесцветная жидкость с
резким запахом и сладким жгучим вкусом, tкип 61,15° С, плотность 1,488 г/см3
(20 °С). Практически нерастворим в воде, смешивается с большинством
органич. растворителей. На свету X. медленно разлагается кислородом воздуха с
образованием фосгена, хлора, хлористого водорода и муравьиной к-ты; для
стабилизации к нему добавляют 1% этилового спирта. Мн. реакции X. проходят
через промежуточное образование дихлоркарбена :ССl2 (см. Карбены),
напр, получение изонитрилов реакцией X. с первичными аминами в
присутствии щелочей; взаимодействие X. с алкоголя-тами RONa, приводящее к
образованию ортоэфиров, и др. Получают X. хлорированием, напр., метана,
ацетона или спирта. Значит, кол-во X. используется в пром-сти для получения
дифторхлорметана CF2C1H (см. Фреоны), а также в качестве
растворителя. X. -препарат из группы наркотических средств. Существует 2
вида его: X., применяемый наружно для растираний, в гистологич. технике как
консервант и фиксатор тканей, иногда внутрь в каплях (напр., при рвоте), и X.
для наркоза (специально очищенный), обладающий сильным наркотическим действием
и относительно высокой токсичностью.
ХЛОРОФОС, трихлорфон, диптерекс, [ССl3СН(ОН)Р(О) (ОСН3)2],
инсектицид широкого спектра действия, используется для борьбы с
вредителями с.-х. растений, эктопаразитами с.-х. животных и вредными насекомыми
в быту. Среднетоксичен для человека и животных.
ХЛОРПИКРИН, трихлорнитрометан, CCl3NO2,
бесцветная маслянистая жидкость с резким запахом; tпл -64 °С, tкип 112,3 °С,
плотность 1,6539 г/см3 (20 °С). Обладает сильным слезоточивым
действием (лакриматор). X. практически нерастворим в воде, хорошо растворим в
органич. растворителях, не гидролизуется водой и водными растворами щелочей,
может быть перегнан с паром. Спиртовые растворы щелочей и водно-спиртовые
растворы Na2S быстро и количественно разрушают (дегазируют) X.; при 400
°С он разлагается на фосген и ClNO. Получают X. хлорированием пикриновой к-ты или её солей (отсюда и назв.).
Минимально действующая концентрация 0,002 мг/л, непереносимая 0,05 мг/л
(2 мин), в больших концентрациях обладает удушающим действием.
Применялся как отравляющее вещество в 1-ю мировую войну 1914-18.
Употребляется для проверки противогазов и как учебное ОВ.
Р. Н.
Стерлин.
ХЛОРСУЛЬФИРОВАННЫИ ПОЛИЭТИЛЕН, сульфохлорирован-
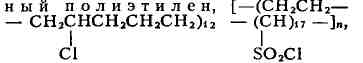
синтетический каучук, продукт химической модификации полиэтилена хлором и
сернистым ангидридом. Плотность 1,11-1,26 г /см3, содержание
хлора 27-45%, серы 0,8-2,2%. Благодаря присутствию хлора X. п. огне- и
маслостоек, устойчив к действию микроорганизмов, обладает хорошей адгезией к
различным поверхностям. Он нерастворим в алифатич. углеводородах и спиртах,
малорастворим в кетонах и сложных эфирах, хорошо - в ароматич. (толуол, ксилол)
и хлорированных углеводородах. X. п. превосходит др. каучуки по стойкости к действию
озона, неорганич. к-т (хромовой, азотной, серной, фосфорной), концентрированных
щелочей, двуокиси хлора, перекиси водорода, отличается высокой светостойкостью,
газонепроницаемостью, хорошими диэлектрич. свойствами. В вулканизации X.
п. участвуют группы -SO2Cl и подвижные атомы хлора (типичная
вулканизующая система содержит MgO, 2-меркаптобензтиазол, дифенилгуанидин,
канифоль). Прочность при растяжении ненаполненных резин из X. п. достигает 32 Мн/м2
(320 кгс/см2) при относительном удлинении 350-600% . Резины
характеризуются высоким сопротивлением истиранию и многократным деформациям.
Температурный диапазон их работоспособности от -60 до 180 "С. X. п. из
полиэтилена высокой плотности может применяться и в невулканизованном виде. X.
п. используют в произ-ве резиновых изделий технич. и бытового назначения, для
получения антикоррозионных покрытий методом гуммирования, для изоляции
кабелей (в т. ч. судовых), как плёнкообразующее лакокрасочных материалов,
к-рыми защищают дерево, металл, железобетон и др., а также как основу клеёв и
герметиков.
Торг. назв. X. п.: ХСПЭ (СССР), хайпалон (США). Мировое произ-во (1976) ок.
30 тыс. га.
Лит.: Энциклопедия полимеров, т. 3, М., 1977.
Г.
М. Ронкин.