ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ, биокатализ, ускорение химических реакций под
влиянием ферментов. В основе жизнедеятельности лежат многочисленные хим.
реакции расщепления питательных веществ, синтеза необходимых организму хим.
соединений и трансформации их энергии в энергию физиол. процессов (работа мышц,
почек, нервная деятельность и т. п.). Все эти реакции не могли бы происходить с
необходимой для живых организмов скоростью, если бы в ходе эволюции не возникли
механизмы их ускорения с помощью Ф. к.
Одно время считалось, что Ф. к. принципиально отличается от небиологического
катализа, широко используемого в хим. произ-ве. Такое представление
основывалось на трёх отличительных особенностях Ф. к.: исключительно высокой
эффективности (увеличение скорости реакции в 1010-1013
раз) и специфичности, т.е. избирательности (способности каждого фермента
катализировать превращение строго определённых биол. субстратов, иногда лишь
единственного вещества, в единственном направлении), не достижимых в
небиологическом катализе. Особенностью Ф. к. является также его регулируемость
- способность биокатализатора - фермента - увеличивать или уменьшать свою
активность в зависимости от потребностей организма. Однако исследование
механизма Ф. к. показывает, что к нему применимы законы и принципы, на к-рых
основаны обычные хим. реакции. Отличие реакций Ф. к. определяется сложностью
структуры ферментов и хим. превращений, к-рые совершают вещества в ходе катализа.
Эффективность Ф. к. достигается в результате того, что хим. реакция
разбивается на ряд энергетически более лёгких промежуточных реакций, в к-рых
участвует фермент. Важнейшая для Ф. к. реакция - образование первичного
фермент-субстратного комплекса даёт выигрыш энергии, достаточный для ускорения
процесса в целом. Представления о необходимости образования такого комплекса
следовали из изучения зависимости скорости ферментативной реакции (V) от
концентрации фермента (Е) и субстрата (S), к-рая описывается уравнением
Михаэлиса - Ментен:
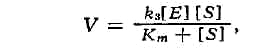
где k3 и Km - константы, характерные для
каждой реакции.
К принципу Ферма: действительный путь света соответствует экстремальному
времени распространения.
Эта зависимость, установленная экспериментально для мн. ферментативных
реакций, может быть теоретически выведена, если превращение субстрата в продукт
реакции (Р) происходит по механизму образования и распада комплекса между
ферментом и субстратом - ES-комплекса:
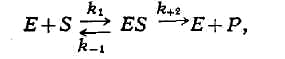
где k1, k-1и k+2 - константы,
характеризующие скорость указанных стрелками стадий процесса, причём
соотношение (k-1 + k+2)/k+1 = Кт.
Если в реакции участвует не один, а неск. (в большинстве случаев
два) субстратов и ES-комплекс образует продукты реакции не в одну, а в неск.
стадий, зависимость выражается более сложными уравнениями, однако и они могут
быть выведены лишь на основе представления о первичном образовании
ES-комплексов. Для мн. ферментов получены прямые доказательства образования
ES-комплексов. Так, спектральными методами доказано образование комплексов с
участием дегидрогеназ и пероксидаз; выделены в кристаллич. состоянии комплексы
оксидазы D-аминокислот с D-аланином, карбоксипептидазы А с глицил-L-тирозином.
В ряде случаев установлено пространственное строение ES-комплексов методом
рентгеноструктурного анализа.
Высокая специфичность Ф. к. объясняется строгим геом. и электронным
соответствием структуры субстрата структуре активного центра фермента,
на к-ром субстрат сорбируется и далее претерпевает хим. превращения.
Допускается, что соответствие (комплементарность) геом. и электронного
строения активного центра и реагирующих с ним участков молекулы субстрата
(субстратов) достигается в момент сближения субстрата с активным центром
(гипотеза индуцированного соответствия Д. Э. Кошленда, США). Активный центр
фермента, представляющий собой ансамбль химически активных группировок
(функциональных групп аминокислот), формируется из остатков аминокислот,
нередко расположенных далеко друг от друга в полипептидной цепи, но сближенных
в пространстве в результате глобулярной структуры белка. Часто в построении
активных центров участвуют низкомолекулярные вещества (ионы металлов, орга-нич.
кофакторы). В молекуле а-химотрипсина, катализирующего гидролиз белков и
полипептидов и имеющего цепь длиной в 246 аминокислотных остатков, активный
центр образован остатками се-рина (порядковый номер остатка в цепи 195),
гистидина (№ 57), изолейцина (№ 16) и аспарагиновой к-ты (№ 102 и № 194).
Активный центр рибонуклеазы, катализирующей расщепление РНК и построенной из
124 аминокислот, образован остатками лизина (№ 7 и № 41), аргинина (№ 39) и
гистидина (№ 12 н № 119). Активные центры мн. ферментов функционируют с
участием низкомолекулярных веществ - кофакторов Ф. к. К ним относятся
производные витаминов, коферменты, а также ионы нек-рых металлов (Na, К,
Са, Mg, Zn, Fe, Си, Со, Mo и др.).
Общая теория Ф. к. не разработана, однако результаты исследования механизма
действия ферментов позволяют качественно, а в отд. случаях и количественно
объяснить высокую активность Ф. к. Её главные причины: 1) сближение реагентов
при сорбции их в активном центре, этот фактор эквивалентен повышению
концентрации реагирующих веществ; 2) специфич. ориентация сорбированного в
активном центре субстрата, благоприятная для взаимодействия с ка-талитич.
участком активного центра; 3) образование хим. связей между субстратом и
каталитич. участком активного центра, направляющее реакцию по энергетически
наиболее лёгкому пути; 4) осуществление всех осн. хим. превращений субстрата
"внутримолекулярное - в составе фермент-субстратного комплекса; 5)
исключительная гибкость молекулы фермента, позволяющая активному центру
принимать на каждой стадии превращения фермент-субстратного комплекса строение,
способствующее достижению максимальной скорости данной стадии реакции. Каждая
предшествующая стадия подготавливает наилучшие условия для последующей.
Ориентировочная оценка суммарного эффекта всех перечисленных факторов Ф. к.
позволяет теоретически предсказать возможное ускорение реакции в 1010-1013
раз, что во мн. случаях совпадает с найденной экспериментально величиной.
Механизмы регуляции активности Ф. к. связаны с особенностями белковой структуры
ферментов. Глобулярное строение ферментов, поддерживаемое относительно слабыми
хим. связями между отд. участками полипептидной цепи, легко нарушается при
изменении кислотности среды, темп-ры, концентрации солей в клетках и т. п.
Поскольку для Ф. к. необходима строго заданная структура фермента, все эти
факторы оказывают воздействие на его активность. Каждый фермент максимально
активен при определённой темп-ре, рН среды и т. п. Изменение условий среды в
обе стороны от оптимума снижает активность Ф. к.; нередко она саморегулируется
продуктом реакции. Для обратимых процессов, когда фермент катализирует прямую и
обратную реакции, скорость прямой реакции (активность Ф. к.) уменьшается при
образовании избытка продукта реакции.
Важную роль в Ф. к. играет т. н. аллостерическая регуляция активности
ферментов. В живой клетке совершается множество последовательных хим. реакций,
катализируемых соответствующими ферментами E1, Е2 и
т. п.
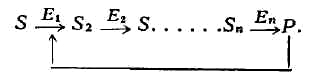
Обнаружены многочисленные реакции, когда образующийся в избытке против
физиологически необходимых количеств продукт Р способен снижать активность
первого фермента E1и тем самым уменьшать скорость всей цепи
реакций. Такой механизм наз. регуляцией по принципу обратной связи. При этом
регулятор Р (в общем случае носит наименование эффектор) воздействует на спец.
регуляторный центр фермента E1, расположенный вдали от
активного центра. Однако вследствие подвижности структуры белковой молекулы
фермента в целом реакция с регуляторным центром приводит к изменению строения и
свойств активного центра. Такой участок получил, по предложению Ф. Жакоба и Ж.
Моно, наименование аллостерического центра, а сами ферменты типа E1
наз. аллостерическими ферментами. В качестве аллостерич. эффекторов
часто выступают нуклеотиды (напр., адениловая к-та, аденозинтрифосфат и т. п.)
и аминокислоты (в реакциях биосинтеза др. аминокислот).
К аллостерич. относят также механизмы регуляции действия фермента,
содержащего неск. активных центров, при к-рых связывание субстрата в активном
центре вызывает изменение (уменьшение или увеличение) активности фермента.
Аллостерич. свойствами обладают ферменты, построенные из неск. (чётного числа)
молекул, каждая из к-рых имеет активный и регуляторный центры. Воздействие
эффектора на регуляторный центр одной из молекул вызывает общее (кооперативное)
изменение строения в др. молекулах и активности фермента в целом. Возможны
также регуляторные механизмы, при к-рых воздействие эффектора на аллостерич.
фермент приводит к изменению степени ассоциации составляющих его субъединиц,
что также сопровождается изменением общей активности фермента. Такого рода
механизмы играют важную роль в регуляции сложной системы хим. реакций (обмена
веществ) в живом организме.
Лит.: Журнал Всес. химического об-ва им. Д. И.
Менделеева", 1971, т. 16, № 4; Дженкс В. П., Катализ в химии и
энзимологии, пер. с англ., М., 1972; Структура и функции активных центров
ферментов. Сб., посвященный 70-летию со дня рождения А. Е. Браунштейна, М., 1974.
В. А. Яковлев.
ФЕРМЕНТЁР, аппарат для глубинного выращивания (культивирования)
микроорганизмов в питат. среде в условиях стерильности, интенсивного
перемешивания, непрерывного продувания стерильным воздухом и постоянной
темп-ры. Ф. представляет собой герметичный цилинд-рич. сосуд - корпус,
снабжённый барботером для подачи стерильного воздуха и мешалкой с
электроприводом. Внутри Ф. вдоль его корпуса и перпендикулярно к нему
закрепляют узкие металлич. полосы - отбойники для повышения эффективности перемешивания.
Объём Ф., предназначенных для лабораторных исследований, чаще до 30 л, для
полузаводских экспериментов - 0,05-5 м3, промышленного
использования - 50-100 м3. Лабораторные ф. могут
изготовляться из термостойкого стекла (их стерилизуют в автоклавах), Ф. больших
размеров - из нержавеющей стали (они имеют паровую рубашку для стерилизации и
поддержания темп-ры). Ф., как правило, оборудуются устройствами для измерения и
регулирования темп-ры, кол-ва продуваемого воздуха и давления внутри Ф. В
случае необходимости Ф. дополнительно снабжается устройствами для измерения и
регулирования рН среды, концентрации растворённого кислорода в культуральной
жидкости, углекислого газа в выходящем воздухе, сигнализатором уровня пены и
приспособлениями для механич. или хим. пеногашения. При непрерывном процессе
культивирования микроорганизмов Ф. дополнительно оборудуются стерилизуемыми
резервуарами для хранения компонентов питат. среды и насосами для их
непрерывной подачи в Ф. Используют Ф. в пром-сти при микробиологическом синтезе
антибиотиков, ферментов, витаминов, аминокислот, нуклеотидов,
белково-витаминных концентратов и т. д., в науч. исследованиях в области
микробиологии, биохимии и др. родств. дисциплин.
Лит.: Уэбб Ф., Биохимическая технология и микробиологический синтез,
пер. с англ., М., 1969; Производство антибиотиков, М., 1970.
М. А. Гильзин.
"ФЕРМЕНТНАЯ И СПИРТОВАЯ ПРОМЫШЛЕННОСТЬ", научно-технич. и
производств. журнал, орган Мин-ва пищ. пром-сти СССР и центр. правления
научно-технич. об-ва пищ. пром-сти. Периодичность 8 номеров в год. Издаётся в
Москве с 1924; назв. менялось (в частности, с 1953 по 1963 назывался
"Спиртовая промышленность"). Освещает достижения науки и техники в
спиртовой, пиво-безалкогольной, ликёро-водочной, ферментной и ацетонобутиловой
пром-сти, опыт передовых предприятий. Тираж (1975) 4600 экз.
ФЕРМЕНТНЫЕ ПРЕПАРАТЫ, лекарственные средства, содержащие ферменты;
оказывают направл. влияние на обмен веществ. Ф. п. получают из продуктов
животного происхождения, растений и микроорганизмов. Желудочный сок, пепсин,
панкреатин и др. Ф. п. и ферменты применяют при желудочно-кишечных
заболеваниях с нарушением функций желез органов пищеварения. Широкое применение
в мед. практике нашли Ф. п. протеолитич. действия (см. Протеолитические
ферменты), получаемые из поджелудочной железы кр. рог. скота (напр., химотрипсин).
Они расщепляют пептидные связи в белках и пептидах. Трипсин при местном
воздействии разрушает некротизированные ткани и фибринозные образования,
разжижает вязкие секреты, экссудат, сгустки крови, при внутримышечном введении
оказывает противовоспалит. действие. Применяют трипсин в виде ингаляций или
внутримышечно для облегчения удаления секрета и экссудата при бронхитах,
бронхоэктатической болезни; при лечении тромбофлебита, остеомиелита, гайморита,
иридоциклита и др. заболеваний; местно - при лечении ожогов, пролежней, гнойных
ран. Дезоксирибонук-леаза уменьшает вязкость гноя, задерживает развитие вирусов
герпеса, аденовирусов; применяют при герпетических и аденовирусных заболеваниях
глаз, абсцессах лёгких, поражен-иях верх. дыхательных путей. Препарат лидаза,
содержащий фермент гиалуронидазу, вызывает увеличение проницаемости тканей и
облегчает движение жидкостей в межтканевых пространствах; применяют при
контрактурах суставов, рубцах после ожогов и операций, гематомах и др. Для
лечения тромбоэмболии, тромбофлебитов, инфаркта миокарда применяют
фибринолизин, растворяющий свежие тромбы. Пенициллиназа, получаемая из культуры
Bacillus cereus, инактивирует препараты пенициллина, в связи с чем применяется при
аллергич. реакциях, вызванных этими препаратами.
В мед. практике применяют также препараты с антиферментной активностью: антихолинэстеразные
средства (угнетают холинэстеразу), нек-рые антидепрессивные средства
(угнетают моно-аминоксидазу); в качестве мочегонных - ингибиторы карбоангидразы
(напр., диа-карб); при острых панкреатитах - ингибиторы протеолитич. ферментов
(напр., трасилол ).
Лит.: Капланский С. Я., Применение ферментных препаратов в терапии
различных заболеваний, в кн.: Актуальные вопросы современной биохимии, т. 2,
М., 1962; Машковский М. Д., Лекарственные средства, 7 изд., ч. 2, М., 1972.
В.
В. Чурюканов.
ФЕРМЕНТНЫЕ ЯДЫ, вещества различной хим. природы, специфически
подавляющие активность определённого фермента или группы родств. ферментов.
По существу Ф. я. представляют собой ингибиторы ферментов, к-рые даже в
очень низких концентрациях угнетают жизненно важные физиол. функции организма.
Мн. ядовитые вещества, т. н. "нервные яды" (люизит),
"дыхательные яды" (цианиды, H2S), пестициды (ядохимикаты)
оказывают отравляющее действие в результате ингибирования отд. ферментов
(напр., холинэстеразы у членистоногих). Изучение влияния Ф. я. на изолированные
ферменты или ферментные системы позволяет целенаправленно искать эффективные
противоядия к определённым отравляющим веществам или новые пестициды для борьбы
с вредными насекомыми, клещами и т. д. и сорняками. Иногда термин "Ф.
я." применяют для обозначения ферментов, входящих в состав ядов змей,
пчёл, скорпионов и др. и разрушающих клетки крови или др. тканей человека и
животных.
ФЕРМЕНТОПАТИИ, энзимопатии, заболевания, обусловленные врождённым
дефектом обмена веществ вследствие ферментных нарушений; относятся к группе наследственных
заболеваний. В основе Ф. лежат различные виды нарушений (полное отсутствие
фермента, снижение его активности, отсутствие или неправильный синтез
кофермента и др.), последствия к-рых в виде определённых аномалий обмена в-в и
определяют в каждом случае специфику клинич. картины Ф. Напр., аномалии
углеводного обмена могут проявляться в виде сахарного диабета, галактоземии;
жирового обмена - в виде болезней Тей-Сакса, Нимана-Пи-ка; аминокислотного
обмена - в виде алкаптонурии, альбинизма и т. п. Известно ок. 500 видов
Ф. Многие из них отличаются полиморфизмом и т. н. гетерогенностью, к-рая
заключается в том, что аномалии различных генов, регулирующих взаимодействие
ферментов, могут иметь идентичные проявления, т. к. ферменты, контролирующие
разные биохим. реакции, нередко дают одинаковый конечный результат метаболизма.
Большинство Ф. передаётся по аутосомно-рецессивному типу наследования. Нек-рые
Ф. могут быть выявлены с помощью экспресс-методов в первые дни жизни ребёнка,
напр. фенилкетонурия. Во многих случаях ранняя диагностика Ф. позволяет
нормализовать обмен веществ с помощью специально подобранной диеты, введения в
организм недостающего вещества (заместительная терапия), гормонов или удаления
избытка продуктов метаболизма, нарушающего обмен веществ. Перспективен также
метод внутриутробной диагностики (изучение культивируемых клеток околоплодной
жидкости, реже - прямое исследование её). В профилактике Ф. возрастает роль медико-генетической
консультации (см. также "Молекулярные болезни", Молекулярная
генетика).
Лит.: Бадалян Л. О., Таболин В. А., Вельтищев Ю. Е., Наследственные
болезни у детей, М., 1971; Xаррис Г., Основы биохимической генетики человека,
пер. с англ., М., 1973; Но well R. R., Moore Ch. M., Prenatal diagnosis in the
prevention of genetic disease, "Texas medicine", 1974, v. 70, № 5, p.
77 - 84.
ФЕРМЕНТЫ (от лат. fermentum - закваска), энзимы, специфические
белковые катализаторы, присутствующие во всех живых клетках. Почти все
био-химич. реакции, протекающие в любом организме и в своём закономерном
сочетании составляющие его обмен веществ, катализируются соответствующими
Ф. Направляя и регулируя обмен веществ, Ф. играют важнейшую роль во всех
процессах жизнедеятельности.
Как всякие катализаторы, Ф. снижают энергию активации, необходимую
для осуществления той или иной хим. реакции, направляя её обходным путём- через
промежуточные реакции, к-рые требуют значительно меньшей энергии активации.
Так, реакция АБ->А + Б в присутствии Ф. идёт след. образом: АБ + Ф->АБФ и
далее АБФ->БФ + А и БФ->Б + Ф. Напр., для осуществления реакции гидролиза
дисахарида сахарозы, в результате к-рого образуются глюкоза и фруктоза, без
участия катализатора требуется 32 000 кал (1 кал = = 4,19 дж) на
моль сахарозы. Если же реакция катализируется Ф. р-фруктофуранозидазой, то
необходимая энергия активации составляет всего 9400 кал. Подобное
понижение энергии активации под влиянием Ф.- следствие перераспределения
электронных плотностей и нек-рой деформации молекул субстрата, происходящей при
образовании промежуточного соединения - фермент-субстратного комплекса (АБФ).
Эта деформация, ослабляя внутримолекулярные связи, приводит к понижению
необходимой энергии активации и, следовательно, ускоряет течение реакции (см.
Катализ, Ферментативный катализ).
История изучения ферментов. В 1814 рус. химик К. Г. С. Кирхгоф открыл
ферментативное действие водных вытяжек из проросшего ячменя, расщеплявших
крахмал до сахара. Можно считать, что эти работы положили начало энзимологии
(ферментологии) как самостоятельному разделу биол. химии. В 1833 франц.
химиками А. Пайеном и Ж. Персо впервые был выделен из солода препарат фермента
амилазы, что способствовало развитию препаративной химии Ф. В сер. 19 в.
разгорелась дискуссия о природе брожения между Л. Постером, с одной
стороны, и Ю. Либихом, П. Э. М. Бертло и К. Бернаром - с другой.
Опираясь на свои классич. работы, Пастер развивал представление о том, что
брожение вызывается лишь живыми микроорганизмами и что процесс брожения
неразрывно связан с их жизнедеятельностью. Либих и его сторонники, отстаивая
хим. природу брожения, считали, что оно является следствием образования в
клетках микроорганизмов растворимых Ф., подобных выделяемой из солода амилазе.
Однако все попытки выделить из разрушенных дрожжевых клеток растворимый Ф.,
способный вызвать брожение, не удавались. Дискуссия Либиха и Пастера о природе
брожения была разрешена в 1897 Э. Бухнером, к-рый, растирая дрожжи с
инфузорной землёй, выделил из них бесклеточный растворимый ферментный препарат
(названный им зимазой), вызывавший спиртовое брожение. Открытие Бухнера
утвердило материалистич. понимание природы брожений и имело большое значение
для дальнейшего развития как энзимологии, так и всей биохимии.
В нач. 20 в. Р. Вильштеттер с сотрудниками стал широко применять для
выделения и очистки Ф. метод адсорбции (впервые предложен А. Я. Данилевским
для разделения Ф. поджелудочной железы). Работы Вильштеттера, имевшие
большое значение для характеристики свойств отдельных Ф., привели вместе с тем
к принципиально неправильному выводу, что Ф. не принадлежат ни к одному из
известных классов органич. соединений. Выдающимся успехом в выяснении хим.
природы Ф. были исследования амер. биохимиков Дж. Самнера, выделившего в
1926 в кристаллич. виде Ф. уреазу из семян канавалии, и Дж. Нортропа,
получившего в 1930 кристаллы протеолитического Ф. пепсина. Работы Самнера и
Нортропа указали путь получения высокоочищенных кристаллич. препаратов Ф. и
вместе с тем неопровержимо доказали белковую природу Ф.
С сер. 20 в. благодаря развитию методов физ.-хим. анализа (гл. обр.
хроматографии)
и методов белковой химии расшифрована первичная структура мн. Ф. Так,
работами амер. биохимиков С. Мура, У. Стайна и К. Анфинсена показано, что Ф.
рибонуклеаза из поджелудочной железы быка представляет собой полипе-птидную
цепочку, состоящую из 124 аминокислотных остатков, соединённых в 4 местах дисульфидными
связями.
С помощью рентгеноструктурного анализа расшифрована вторичная и третичная
структура ряда Ф. Так, методом рентгеноструктурного анализа англ. учёный Д.
Филлипс в 1965 установил трёхмерную структуру Ф. лизоцима. Показано, что
мн. Ф. обладают также четвертичной структурой, т. е. их молекула состоит из
неск. идентичных или различных по составу и структуре белковых субъединиц (см.
Биополимеры).
Общая характеристика ферментов. Все Ф. разделяются на две большие группы:
однокомпонентные, состоящие исключительно из белка, и двухкомпонентные,
состоящие из белка, наз. апоферментом, и небелковой части, нач. простетической
группой. Апофермент двухкомпонентных Ф. наз. также белковым носителем, а
простетическую группу - активной группой. Благодаря работам О. Варбурга, А.
Теорелля, Ф. Линена, Ф. Лип-мана и Л. Лелуара установлено,
что простетические группы мн. Ф. представляют собой производные витаминов или
нуклеотидов. Т. о. была открыта важнейшая функциональная связь между
Ф., витаминами и нуклеотидами, являющимися строительными
"кирпичиками" нуклеиновых к-т.
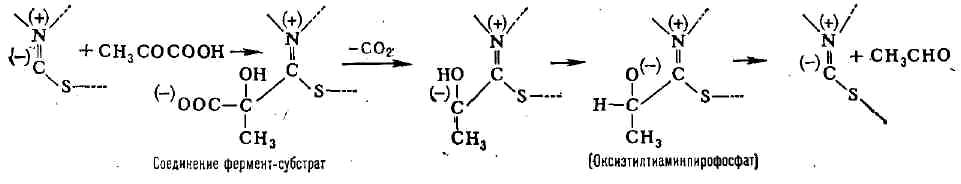
Примером двухкомпонентного Ф. является пируватдекарбоксилаза, катализирующая
расщепление пировиноградной кислоты на двуокись углерода и уксусный альдегид:
СНзСОСООН-> ->СН3СНО + СО2. Про-стетич. группа
пируват-декарбоксилазы (тиаминпирофосфат) образована молекулой тиамина
(витамина B1) и двумя остатками фосфорной кислоты. Простетические
группы ряда важных окислительно-восстановительных Ф. - дегидрогеназ содержат
производное амида никотиновой к-ты (ниацина), или же рибофлавина (витамина В2);
в состав простетич. группы т. н. пиридоксалевых ферментов, катализирующих
перенос аминогрупп (-NH2) и декарбоксилирование и ряд др.
превращений аминокислот, входит пиридоксальфосфат - производное витамина Be; активная
группа Ф., катализирующих перенос остатков различных органич. к-т (напр.,
ацетила СН3СО-), включает витамин пантотеновую кислоту. К
двухкомпонентным, Ф. относятся также важные окислительные Ф.- каталаза (катализирует
реакцию разложения перекиси водорода на воду и кислород) и пероксидаза (окисляет
перекисями различные соединения, напр. полифенолы с образованием
соответствующего хинона и воды). Каталитич. действие этих Ф. может быть
воспроизведено с помощью ионов трёхвалентного железа. Эти ионы обладают,
однако, очень малой каталитич. активностью, к-рая может быть усилена, если атом
железа входит в состав гема. Хотя гем обладает уже значит. каталазным
действием, его каталитич. активность всё же в неск. миллионов раз меньше
активности каталазы, в к-рой гем в качестве простетич. группы этого Ф. связан
со специфич. белком. Гем обладает также слабым пероксидазным действием, однако
это действие проявляется в полной мере только после соединения гема со
специфич. белком в целостный Ф. пероксидазу. Т. о., соединение простетич.
группы с белком приводит к резкому возрастанию её каталитич. активности. Вместе
с тем от природы белка зависит не только каталитич. активность, но и
специфичность действия Ф. Прочность связи простетич. группы и апофермента
различна у разных Ф. У некоторых Ф., напр. у дегидрогеназ, катализирующих
окисление различных субстратов путём отщепления водорода, эта связь является
непрочной. Такие Ф. легко диссоциируют (напр., при диализе) и
распадаются на простетич. группу и апофермент. Простетические группы, легко
отделяющиеся от белковой части Ф., наз. коферментами.
Многие Ф. содержат металлы, без которых Ф. не активен. Эти металлы наз.
кофакторами. Так, пероксидаза и каталаза содержат железо, аскор-бинатоксидаза,
катализирующая окисление аскорбиновой кислоты,- медь, алкогольдегидрогеназа,
окисляющая спирты в соответствующие альдегиды,- цинк.
Специфичность и механизм действия ферментов. Действие Ф., в отличие от
неорганич. катализаторов, строго специфично и зависит от строения субстрата, на
к-рый Ф. действует. Прекрасным примером такой зависимости служит катализируемая
аргиназой реакция гидро-литич. расщепления аминокислоты аргинина на орнитин и
мочевину:
Первичная структура (последовательность аминокислотных остатков) фермента
рибонуклеазы из поджелудочной железы быка. Чёрным обозначены 4 дисульфидных
мостика, скрепляющих полипептидную цепь фермента.
Однако аргиназа не расщепляет метилового эфира аргинина:
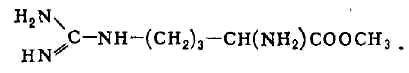
Дипептид, состоящий из остатков двух молекул аргинина, под действием
аргиназы даёт лишь половину теоретич. кол-ва мочевины. Очевидно, что, хотя
расщепление аргинина происходит в месте, весьма отдалённом от карбоксильной
(СООН) группы (показано пунктиром), необходимым условием действия аргиназы
является её соединение с карбоксильной группой аргинина. Поэтому замещение
водорода в карбоксильной группе на метальный остаток или же связывание
карбоксильной группы со второй молекулой аргинина оказывают резкое влияние на
действие аргиназы. Примеры специфичности действия Ф. могут быть приведены при
рассмотрении их стереохимич. специфичности, т. е. действия Ф. на стереоизомеры
(см. Изомерия). Так, Ф., окисляющий природные L-аминокислоты, не
действует на D-изомеры этих же аминокислот; Ф. дипептидаза, гидролизирующий
дипептиды, состоящие из остатков L-аминокислот, не действует на такие же
дипептиды, состоящие из остатков D-аминокислот. Специфичность действия Ф.
послужила нем. учёному Э. Фишеру основанием для сравнения субстрата и
Ф., к-рый катализирует его превращение, с замком и соответствующим ему ключом.
Стереохим. специфичность Ф. теснейшим образом связана с одной из осн.
особенностей живых организмов - их способностью к синтезу оптически активных
органических соединений.
В образовании соединения между ферментом и субстратом - т. н.
фермент-субстратного комплекса - принимают участие лишь нек-рые функциональные
группы молекулы Ф., образующие его активный центр. Так, напр., в
молекуле гидролизирующего белки химотрипсина, состоящего из 246 аминокислотных
остатков, активный центр образован одним из остатков серина (химотрипсин
относится к сериновым протеиназам) и двумя остатками гистидина, расположенными
в удалённых друг от друга участках полипептидной цепи. Сближение этих
функциональных групп активного центра происходит благодаря свойственной
молекуле химотрипсина специфич. пространственной (третичной) структуре. Её
нарушение в результате денатурации белка или каких-либо хим. модификаций
приводит к изменению или полной потере каталитич. активности. В случае
двухкомпонентных Ф. в образовании фермент-субстратного комплекса принимают
участие не только функциональные группы апофермента, но и простетич. группа.
Так, при расщеплении пировиноградной к-ты пируватдекарбоксилазой субстрат
связывается с частью молекулы тиамин-пирофосфата след. образом:
Исключительно высокая специфичность действия Ф. объясняется их белковой
природой. Так, пиридоксалевые Ф., содержащие один и тот же кофермент
(пиридоксальфосфат), могут принадлежать к различным классам и катализировать
самые разнообразные реакции. Специфичность их действия зависит от природы
апофермента.
Условия действия ферментов. Действие Ф. зависит от ряда факторов,
прежде всего от темп-ры и реакции среды (рН). Оптимальная темп-pa, при к-рой
активность Ф. наиболее высока, находится обычно в пределах 40-50 °С. При более
низких темп-pax скорость ферментативной реакции, как правило, снижается, а при
темп-pax, близких к О °С, практически реакция полностью прекращается. При
повышении темп-ры выше оптимальной скорость ферментативной реакции также
снижается и, наконец, полностью прекращается. Снижение интенсивности действия
Ф. при повышении темп-ры сверх оптимальной объясняется гл. обр. начинающимся
разрушением (денатурацией) входящего в состав Ф. белка. Поскольку белки в сухом
состоянии денатурируются значительно медленнее, чем белки оводнённые (в виде
белкового геля или раствора), инактивирование Ф. в сухом состоянии происходит
гораздо медленнее, чем в присутствии влаги. Поэтому сухие споры бактерий или
сухие семена могут выдержать нагревание до гораздо более высоких темп-р, чем те
же споры или семена в увлажнённом состоянии.
Важнейшим фактором, от к-рого зависит действие Ф., как установил впервые С. Сёренсен,
является активная реакция среды - рН. Отдельные Ф. различаются по
оптимальной для их действия величине рН. Так, напр., пепсин, содержащийся в
желудочном соке, наиболее активен в сильнокислой среде (рН 1-2); трипсин -
протеолитич. Ф., выделяемый поджелудочной железой, имеет оптимум действия в
слабощелочной среде (рН 8- 9); оптимум действия папаина - протеолитич. Ф.
растит. происхождения - находится в слабокислой среде (рН 5-6). Действие Ф.
зависит также от присутствия специфич. активаторов и неспецифич. или специфич.
ингибиторов. Так, энтерокиназа, выделяемая поджелудочной железой, превращает
неактивный трипсиноген в активный трипсин. Подобные неактивные Ф.,
содержащиеся в клетках и в секретах различных желез, наз. проферментами. Многие
Ф. активируются в присутствии соединений, содержащих сульфгидрильную группу (-
SH). К ним принадлежат аминокислота цистеин и трипептид глутатион, содержащийся
в каждой живой клетке. Особенно сильное активирующее действие глутатион
оказывает на нек-рые протеолитич. и окислительные Ф. Неспецифич. угнетение
(ингибирование) Ф. происходит под действием различных веществ, дающих с белками
нерастворимые осадки или блокирующих в них к.-л. группы (напр., SH-группы).
Существуют более специфич. ингибиторы Ф., угнетение к-рыми каталитич. функций основано на
специфич. связывании этих ингибиторов с определёнными хим. группировками в
активном центре Ф. Так, окись углерода (СО) специфически ингибирует ряд
окислит. Ф., содержащих в активном центре железо или медь. Вступая в хим.
соединение с этими металлами, она блокирует активный центр Ф. и вследствие
этого он теряет свою активность. Различают обратимое и необратимое
ингибирование Ф. В случае обратимого ингибирования (напр., действие малоновой
к-ты на сукцинатдегидрогеназу) активность Ф. восстанавливается при удалении
ингибитора диализом или иным способом. При необратимом ингибировании действие
ингибитора, даже при очень низких его концентрациях, усиливается со временем и
в конце концов наступает полное торможение активности Ф. Ингибирование Ф. может
быть конкурентным и неконкурентным. При конкурентном ингибировании ингибитор и
субстрат конкурируют между собой, стремясь вытеснить один другого из
фермент-субстратного комплекса. Действие конкурентного ингибитора снимается
высокими концентрациями субстрата, в то время как действие неконкурентного ингибитора
в этих условиях сохраняется. Действие на Ф. специфич. активаторов и ингибиторов
имеет большое значение для регулирования ферментативных процессов в организме.
Классификация и номенклатура ферментов. По рекомендации
Международного биохим. союза, Ф. разделяют на 6 классов: 1) оксидоредуктазы, 2)
транс-феразы, 3) гидролазы, 4) лиазы, 5) изомеразы, 6) лигазы. Рекомендована
следующая нумерация Ф. Шифр (индекс) каждого Ф. содержит 4 числа, разделённых
точками. Первая цифра указывает класс, вторая - подкласс, третья -
подподкласс, четвёртая - порядковый номер в данном подподклассе. Так, Ф.
аргиназа, расщепляющий аргинин на орнитин и мочевину, имеет шифр 3.5.3.1, т. е.
относится к классу гидролаз, подклассу Ф., действующих на непептидные С -
N-связи, иподподклассу Ф., расщепляющих эти связи в линейных (не циклических)
соединениях.
Класс оксидоредуктаз включает Ф., катализирующие окислительно-восстановит.
реакции, и разделяется на 14 подклассов в зависимости от природы той группы в
молекуле субстрата, к-рая подвергается окислению (спиртовая, альдегидная,
кетонная и т. д.). Подподклассы оксидоредуктаз индексируются в зависимости от
типа участвующего в реакции акцептора водорода (электронов) - кофермента,
цитохрома, молекулярного кислорода и т. д. Т. о., первые три цифры шифра
определяют тип Ф., так, напр., 1.2.3 обозначают оксидоредуктазу, действующую на
альдегид с молекулярным кислородом в качестве акцептора электронов. Класс
трансфераз, объединяющий Ф., катализирующие реакции переноса групп, подразделяется
на
8 подклассов в зависимости от природы переносимых групп, к-рыми могут быть
одноуглеродные или гликозиль-ные остатки, азотистые или содержащие серу группы
и т. д. У трансфераз третья цифра характеризует тип переносимых групп (напр.,
одноуглеродная группа может быть метилом, карбоксилом, формилом и т. д.). К
гидролазам принадлежат Ф., катализирующие гидролитич. расщепление различных
соединений; разделяются на 9 подклассов в зависимости от типа
гидролизуемой связи - сложноэфирной, пептидной, гликозидной и т. д. Третья
цифра у гидролаз уточняет тип гидролизуемой связи. Лиазы - Ф., отщепляющие от
субстрата ту или иную группу (негидролитич. путями) с образованием двойной
связи или, наоборот, присоединяющие группы к двойным связям. У лиаз 5
подклассов, вторая цифра шифра обозначает тип подвергающейся разрыву связи
(углерод - углерод, углерод - кислород и т. д.), а третья - тип отщепляемой
группы. Изомеразы, катализирующие реакции изомеризации, разделяются на 5
подклассов в зависимости от типа катализируемой реакции; третья цифра шифра
детализирует характер превращения субстрата. Лигазами (или синтетазами) наз.
Ф., к-рые катализируют соединение двух молекул, сопряжённое с расщеплением
пирофосфатной связи в молекуле аденозинтрифосфорной к-ты (АТФ) или аналогичного
трифосфата. Первая цифра шифра лигаз обозначает тип вновь образуемой связи
(углерод - азот, углерод - кислород и т. д.), а вторая - природу образующегося
соединения.
Классификация и номенклатура Ф., кроме шифра, включает также систематич. и
тривиальные (рабочие) названия. Так, напр., систематич. назв. карбоксилаза
2-оксокислот соответствует уже упоминавшемуся тривиальному назв.
пируватдекарбоксилаза, а систематич. назв. L-аргинин - амидиногидролаза -
рабочему назв. аргиназа.
Регуляция ферментативных процессов. Действие Ф. в организме
осуществляется путём регуляции их синтеза и активности. Свойственный данному
организму набор Ф. определяется его генетич. природой. Однако он может изменяться
под влиянием различных внутр. и внеш. факторов - мутаций, действия ионизирующей
радиации, состава газовой среды, условий питания и т. д. Так, в результате
мутаций возникают т. н. "молекулярные болезни" (напр.,
алкаптонурия). При этом наследств. заболевании у больных с мочой выделяется
гомогентизиновая к-та, образующаяся в результате превращений аминокислоты тирозина.
Гомогентизиновая к-та накапливается в организме и выделяется с мочой
вследствие того, что у больных алкаптонурией утеряна способность к синтезу двух
Ф., катализирующих её дальнейшее окисление, - параоксифенилпируватоксидазы и
оксидазы гомогентизиновой к-ты. Влияние условий питания организма на его
ферментный аппарат особенно наглядно прослеживается у микроорганизмов. Напр.,
кишечная палочка при росте на питат. среде, содержащей глюкозу, синтезирует
только следы в-галактозидазы. В присутствии же различных в-галактозидов
образуются значит. кол-ва этого Ф.- до 6-1% от всех содержащихся в
клетке белков. Ф., новообразование или усиление синтеза к-рых происходит под
влиянием к.-л. соединения, наз. индуцируемыми ферментами. Под влиянием
др. соединений может происходить подавление синтеза Ф., наз. репрессией. В
животном организме индукция и репрессия синтеза Ф. осуществляется не только под
влиянием соответствующих субстратов и метаболитов, но и под влиянием гормонов. Так, синтез
глюкозо-6-фосфатазы, принимающей участие в синтезе глюкозы в печени,
индуцируется гормонами тироксином и кортизоном, но репрессируется инсулином.
Общая теория индукции и репрессии биосинтеза на генетич. уровне дана франц.
учёными Ф. Жакобом и Ж. Моно (см. Оперон). В одном
организме один и тот же Ф. может быть представлен различными молекулярными
формами. Такие разнообразные формы Ф., катализирующие одну и ту же реакцию, но
различающиеся по физ., хим. и иммунологич. свойствам, наз. изоферментами. Синтез
изоферментов определяется генетич. факторами, но может изменяться под влиянием
условий существования организма. Т. о., факторы, от к-рых зависят концентрация
и активность Ф. в организме, так же разнообразны, как и условия его
существования. Это прежде всего водный, газовый, температурный, кислотный и
световой режим среды, а также концентрация субстратов и различных кофакторов,
необходимых для действия Ф., наличие активаторов и ингибиторов, концентрации
метаболитов и, наконец, у высших многоклеточных организмов это нервная и
гормональная регуляция ферментативной активности .
Примером влияния условий существования организма на активность Ф. может
служить Постера эффект - прекращение брожения под действием кислорода.
Активность многих Ф. регулируется по аллостерическому принципу. У таких Ф.
имеется т. н. аллостерический центр, присоединяясь к к-рому определённый
метаболит - эффектор вызывает изменение структуры активного центра, вследствие
чего активность Ф. снижается или повышается.
Нек-рые Ф. находятся в клетке в виде многоферментных комплексов. В таких
многоферментных ансамблях активность каждого отдельного Ф. строго
координирована и регулируется др. Ф., входящими в состав данного комплекса.
Примером многоферментного комплекса может служить пируватдегидрогеназа,
состоящая из 16 молекул пируватдекарбоксилазы, 8 молекул
дигидролипоилдегидрогеназы и 4 агрегатов липоат-ацетил-трансферазы, каждая из
к-рых состоит из 16 субъединиц. Решающую роль в регуляции активности Ф. в
клетке играют различные субклеточные структуры - митохондрии, микросомы,
лизосомы и т. д., и белково-липидные мембраны, отделяющие их от цитоплазмы.
Многие Ф. вмонтированы в этих мембранах в виде многоферментных ансамблей.
Практическое значение ферментов. Ферментативные процессы являются
основой мн. произ-в: хлебопечения, виноделия, пивоварения, сыроделия, произ-ва
спирта, чая, уксуса. С нач. 20 в. по предложению япон. учёного Д. Такамине в
спиртовой и др. отраслях пром-сти началось применение ферментных препаратов,
получаемых из плесневых грибов или бактерий. В ряде стран этот способ широко
используется для осахаривания с помощью амилаз крахмалистого сырья с целью
получения кристаллич. глюкозы или его сбраживания на спирт. Концентрированные
амилолитич. препараты Ф. из плесневых грибов при добавке в тесто приводят к
улучшению качества хлеба и ускорению технологич. процесса. Препараты
протеолитич. Ф., получаемых из микроорганизмов, употребляются в кож. пром-сти
для удаления волос и мягчения сырья, а в сыродельной пром-сти - для замены
дефицитного сычужного фермента (реннина). Препараты микробных
пектолитич. Ф. широко используют при производстве соков (выход плодового сока
повышается на 10- 20% ). Всё большее применение очищенные ферментные
препараты находят в медицине. В науч. исследованиях и в кли-нич. практике
высокоочищенные ферментные препараты служат в качестве специфич. средств
биохим. анализа (см. Ферментативные методы анализа). Весьма перспективно
применение т. н. иммобилизованных Ф., к-рые связываются к.-л. носителем,
образующим с данным Ф. нерастворимый комплекс. При подборе соответствующего
носителя можно получить иммобилизованный Ф. с высокой активностью, устойчивый
по отношению к денатурирующим агентам. Колонка, заполненная иммобилизованным
Ф., может быть многократно использована для проведения соответствующей реакции.
Иммобилизованные Ф. находят всё более широкое применение в аналитич. практике и
биохим. технологии.
Лит.: Ферменты, М., 1964; Диксон М., Уэбб Э., Ферменты, пер. с англ.,
М., 1966; Номенклатура ферментов, пер. с англ., М., 1966; Бернхард С.,
Структура и функция ферментов, пер. с англ., М., 1971; Структура и функция
ферментов, в. 1- 2, М., 1972-73; Фениксова Р. В., Биохимические основы получения
и применения ферментных препаратов, в кн.: Техническая биохимия, М., 1973;
Кретович В. Л., Введение в энзимологию, 2 изд., М., 1974; Аллостерические
ферменты, М., 1975; Ферменты медицинского назначения. Л., 1975; Ферментные препараты в пищевой промышленности, М., 1975; Advances in enzymology and related areas of molecular biology,
v. 1 - 43, N. Y., 1941 - 75; Methods in enzymology, v. 1 - 36, N. Y., 1955-75.
В.
Л. Кретович.
ФЕРМЕР в капиталистич. странах, предприниматель в с. х-ве, владелец
с.-х. предприятия (см. Фермерское хозяйство).
ФЕРМЕРСКОЕ ХОЗЯЙСТВО в капиталистических странах, частное товарное
с.-х. предприятие предпринимательского типа, ведущееся на собств. или
арендованной земле. Как правило, связано с хуторским характером поселения. Цель
ведения Ф. х.- получение ден. дохода в форме прибыли. Возникло с развитием
капитализма, с вовлечением с. х-ва в систему рыночных отношений. Отмечая
историч. прогрессивность Ф. х. как формы капиталистич. хозяйствования на земле,
В. И. Ленин подчёркивал, что "основой капиталистического земледелия
становится свободный фермер на свободной, т. е. очищенной от всего
средневекового хлама, земле" (Полн. собр. соч., 5 изд., т. 17, с. 150),
что фермер - это предприниматель в земледелии (см. там же). Различия в генезисе,
степени развитости, социально-экономич. содержании Ф. х. в разных странах
определяются особенностями и уровнем развития капиталистич. производств.
отношений в с. х-ве, а также характером и степенью использования труда
(семейного и наёмного), условиями землепользования, уровнем индустриализации
с.-х. произ-ва, объёмом капиталовложений, степенью производств. специализации,
товарности, интенсивностью межотраслевых и межхозяйственных связей.
Наиболее раннее и полное развитие Ф. х. получило в странах,
для к-рых был характерен т. н. амер. путь развития капитализма в с. х-ве (США,
Канада, Австралия, Н. Зеландия), где оно возникло в результате колонизации как
свободных, так и захваченных у туземного населения земель. В большинстве
зап.-европ. стран становление Ф. х. происходило в условиях прусского пути
развития капитализма в сельском хозяйстве (см. Аграрный вопрос), в ходе
длительной эволюции помещичьих хозяйств в крупные капиталистические
предприятия, а крестьянства либо в наёмных рабочих, либо в сел. буржуазию (фермеров).
Исключение составляла Великобритания, где в связи с полной ликвидацией крест.
зем. собственности в результате огораживаний (17 в.) Ф. х. (гл. обр. на
арендованной земле) раньше, чем в др. странах Зап. Европы, стало господствующей
формой с.-х. произ-ва. В 20-30-х гг. 20 в. с. х-во США, Канады, Н. Зеландии,
Великобритании, а в 50-60-х гг. и зап.-европ. развитых капиталистич. стран
перешло к машинной стадии произ-ва, в результате чего фермеры стали осн.
производителями товарной с.-х. продукции в этих странах. Оно целиком основано
на товарно-ден. отношениях и подчинено действию законов капиталистич. конкуренции.
Развитие с. х-ва на индустриальной основе привело к резкому увеличению
фондовооружённости и капиталоёмкости Ф. х., экономич. жизнестойкость к-рых
стала определяться нормой накопления капитала. Чтобы выдержать конкурентную
борьбу, фермеры должны постоянно расширять выпуск товарной продукции путём
совершенствования хоз. деятельности, роста механизации, интенсификации,
специализации произ-ва на базе непрерывного увеличения капиталовложений, а
также за счёт концентрации земли в одном х-ве. Так, в США в 1974 ср. размер
одной фермы составлял 180 га (в 1940 - 70 га, в 1910 - 55 га);
в Великобритании в 1973 - ок. 50 га (в 1960 - 32 га), во
Франции - 23 га (в 1956-14 га), в Дании и Швеции- 22 га (в
1951 - 15 га и в 1956 - 13 га соответственно), в ФРГ - 13 га, в
Нидерландах - 14 га (в 1950 - 8 и 10 га соответственно). Рост
концентрации произ-ва усиливает процесс расслоения фермерства, вызывая массовое
разорение и ликвидацию мелких и рост экономич. мощи крупных Ф. х. Так, в США в
1950 фермы со стоимостью товарной продукции в 10 тыс. долл., составлявшие 32,6%
всех ферм, давали 75,4% товарной продукции с. х-ва; в 1974 те же фермы (48,9%
общего числа х-в) производили 95,1% продукции, в т. ч. крупнокапиталистические
(со стоимостью годового произ-ва св. 40 тыс. долл., 16,6% всех ферм) - 71,1%
товарной продукции (в 1950 таких ферм было 2,8% и их уд. вес в произ-ве
составлял 26,7%). В 6 странах Зап. Европы - основателях Европейского
экономического сообщества - в кон. 60-х гг. 13,4% суммарного числа с.-х.
предприятий (с годовой поставкой товарной продукции на сумму св. 7,5 тыс.
расчётных единиц ЕЭС) обеспечивали св. 50% поставок продукции с. х-ва. В
Великобритании в 1970 10% Ф. х. производили 50% товарной продукции.
В доиндустриальный период развития с. х-ва осн. масса Ф. х. велась на базе
использования труда наёмных рабочих. С переходом с. х-ва к машинной ста дии в
издержках произ-ва падает доля живого и растёт уд. вес овеществлённого труда,
роль постоянного капитала значительно возрастает. Рост органического
строения капитала сопровождается уменьшением доли наёмных рабочих, к-рая в
60-70-х гг. 20 в. в общем числе занятых в сельском хозяйстве почти, всех
развитых капиталистических стран была ниже, чем владельцев сельскохозяйственных
предприятий и семейных рабочих [см. "Устойчивости семейных хозяйств (ферм)"
теория]. В нач. 70-х гг. в США наёмные рабочие обеспечивали
немногим более 25% всех трудовых затрат в произ-ве с.-х. продукции, в 6 странах
- основателях ЕЭС -23,2% , в Швеции - 12,6%, в Дании - 11,9% и т. д. По мере
роста концентрации с.-х. произ-ва наёмный труд всё в большей степени
сосредоточивается в крупных капиталистич. х-вах. Фактическое использование
наёмного труда в Ф. х. характеризуется более высокими показателями, т. к. часть
трудовых затрат в них осуществляется наёмными рабочими др. отраслей через
оказание различного рода производств. услуг специализированными
несельскохозяйственными фирмами. Многие Ф. х. (и в первую очередь крупные
специализированные) втянуты в систему экономич. межотраслевых связей,
организуемых крупными пром. компаниями и кооперативами на основе вертикальной
интеграции. Развитие этих связей ведёт к потере экономич. самостоятельности
Ф. х., к-рые превращаются в составную часть крупных капиталистич. аграрно-промышленных
объединений. См. также ст. Крестьянство.
Лит.: Ленин В. И., Экономическое содержание народничества и критика
его в книге г. Струве, Полн. собр. соч., 5 изд., т. 1; его же, К характеристике
экономического романтизма, там же, т. 2; его же, Развитие капитализма в России,
там же, т. 3; его же, Марксистские взгляды на аграрный вопрос в Европе и
России, там же, т. 7; его же , Аграрная программа социал-демократии в первой
русской революции 1905-1907 годов, там же, т. 16; его же, Аграрный вопрос в
России к концу XIX века, там же, т. 17; его же, Новые данные о законах развития
капитализма в земледелии, там же, т. 27; Развитые капиталистические страны:
проблемы сельского хозяйства, М., 1969; Надель С. Н., Социальная структура
современной капиталистической деревни, М., 1970; Мартынов В. А., Сельское
хозяйство США и его проблемы. (Научно-техническая революция и аграрные
отношения), М., 1971; Сельское хозяйство капиталистических и развивающихся
стран, М., 1973; Последствия индустриализации сельского хозяйства в странах
Западной Европы, М., 1975.
В. Д. Мартынов.
ФЕРМИ (Fermi) Энрико (29.9.1901, Рим,
- 28.11.1954, Чикаго),
итальянский физик, внёсший большой вклад в развитие совр. теоретич. и экспериментальной
физики. После окончания в 1922 Пизанского ун-та учился в Германии и
Нидерландах. В 1926-38 проф. Римского ун-та; Ф. оказал большое влияние на
формирование итал. школы совр. физики. В 1938 он эмигрировал из фашистской
Италии. В 1939-45 проф. Колумбийского ун-та, руководил исследоват. работами США
в области использования ядерной энергии. С 1946 проф. Чикагского ун-та.
Ф. принимал деятельное участие в создании основ квантовой физики. В 1925 он
разработал статистику частиц, подчиняющихся Паули принципу (см. Ферми -
Дирака статистика). В 1934 создал количественную теорию в-распада,
основанную на предположении В. Паули о том, что в-частицы испускаются
одновременно с нейтрино. В 1934-38 Ф. с сотрудниками изучал свойства нейтронов
и практически заложил основы нейтронной физики: впервые наблюдал искусств. радиоактивность, вызванную бомбардировкой нейтронами
ряда элементов (в т. ч. урана), открыл явление замедления нейтронов и
создал теорию этого явления (Нобелевская пр., 1938). В дек. 1942 Ф. впервые
удалось осуществить ядерную цепную реакцию в построенном им первом в мире ядерном
реакторе, где в качестве замедлителя нейтронов использовался графит, в
качестве горючего - уран.
Последние годы жизни занимался физикой высоких энергий. Впервые начал экспериментальные
исследования взаимодействий заряженных я-мезонов разных энергий с водородом и
получил ряд фундаментальных результатов. Ф. принадлежат также теоретич. работы
в области физики высоких энергий (статистическая теория множественного
образования мезонов в соударении двух нуклонов, теория происхождения космич.
лучей и др.).
Соч.: Zur Quantelung des
idealen einatomi-gen Gases, "Zeitschrift fur Physik", 1926, Bd 36, H.
11/12; Artificial radioactivity produced by neutron bombardment,
"Procedings of the Royal Society", s. A, 1934, v. 146, № 857; то же, там же, 1935, v. 149, № 868 (совм. с др.); On the
absorption and the diffusion of slow neutrons, "Physical Review", s.
2, 1936, v. 50, № 10 (совм. с E.Amaldi);
Tentative di una Teoria dei raggi ("3", "Nuovo Cimento",
1934, v. 11,№1; в рус. пер.- Ядерная физика, М., 1951; Лекции по
атомной физике, М., 1952; Элементарные частицы. 2 изд., М., 1953; Молекулы и
кристаллы, М., 1947; Элементарная теория котлов с цепными ядерными реакциями,
"Успехи физических наук", 1947, т. 32, в. 1, с. 54-65; Лекции о
л-мезонах и нуклонах, М., 1956; Научные труды т. 1 - 2, М., 1971 - 1972;
Термодинамика, 2 изд., Хар., 1973.
Лит.: Понтекорво Б., Энрико Ферми, "Успехи физических
наук", 1955, т. 57, в. 3; Ферми Л., Атомы у нас дома, пер. с англ., М.,
1958.
Б. М. Понтекорво.
ФЕРМИ, внесистемная единица длины, равная 10-13 см. Названа
в честь Э. Ферми. Применяется в ядерной физике.
ФЕРМИ, Терми, древний город на о. Лесбос эпохи энеолита и ранней
бронзы (нач. 3-го тыс. до н. э.- ок. 1200 до н.э.). Раскапывался в 1929-33
англ. учёным У. Лэмбом. 5 последоват. напластований показывают непрерывный рост
Ф. от небольшого городка с двухкомнатными домами и меднолитейным произ-вом к
крупному городу с оборонит. стенами, мощёными улицами, бронзолитейным делом
(ок. 25 в. до н. э.). Во 2-м тыс. до н. э.- один из очагов крито-микенской
культуры, в 14-13 вв. до н. э.- центр почитания Геры.
Лит.:
Lamb W., Excavations at Thermi in
Lesbos, Camb., 1936.
ФЕРМИ ПОВЕРХНОСТЬ, изоэнергетическая поверхность в пространстве
квазиимпульсов р, отделяющая область занятых электронных состояний
металла от области, в к-рой при Т - О К электронов нет. За большинство
свойств металлов ответственны электроны, расположенные на Ф. п. и в
узкой области пространства квазиимпульсов вблизи неё. Это связано с
высокой концентрацией электронов проводимости в металле, плотно заполняющих
уровни в зоне проводимости (см. Вырожденный газ, Твёрдое тело). Каждый
металл характеризуется своей Ф. п., причём формы поверхностей разнообразны
(рис.). Для "газа свободных электронов" Ф. п.- сфера. Объём,
ограниченный Ф. п. QF (приходящейся на 1 элементарную ячейку в
пространстве квазиимпульсов), определяется концентрацией п электронов
проводимости в металле: 2QF/(2пh)3 = =
п. Средние размеры Ф. п. для хороших металлов ~h/a, где h - Планка
постоянная, а - постоянная решётки, обычно п =1/а3. У
большинства металлов, кроме большой Ф. п., обнаружены малые полости, объём
к-рых значительно меньше, чем (2пh)3n/2. Эти полости
определяют многие квантовые свойства металлов в магнитном поле (напр., де
Хааза - ван Альфена эффект). У полуметаллов объём Ф. п. мал по
сравнению с размерами элементарной ячейки в пространстве квазиимпульсов. Если
занятые электронами состояния находятся внутри Ф. п., то она наз. электронной,
если же внутри Ф. п. электронные состояния свободны, то такая поверхность наз.
дырочной. Возможно одновременное существование обеих Ф. п. Напр., у Bi Ф. п.
состоит из 3 электронных и 1 дырочного эллипсоидов. В Ф. п. находит отражение симметрия
кристаллов. В частности, они периодичны с периодом 2 пhb, где b -
произвольный вектор обратной решётки. Все Ф. п. обладают центром симметрии.
Встречаются Ф. п. сложной топологии (с самопересечениями), к-рые одновременно
являются и электронными, и дырочными. Если Ф. п. непрерывно проходит через всё
пространство квазиимпульсов, она наз. открытой. Если Ф. п. распадается на
полости, каждая из к-рых помещается в одной элементарной ячейке пространства
квазиимпульсов, она наз. замкнутой, напр. у Li, Au, Cu, Ag - открытые Ф. п., у
К, Na, Rb, Cs, In, Bi, Sb, Al - замкнутые. Иногда Ф. п. состоит из открытых и
замкнутых полостей. Скорости электронов, расположенных на Ф. п.: vF
= 108 см/сек, вектор v направлен по нормали к Ф.
п.
Геометрич. характеристики Ф. п. (форма, кривизна, площади сечений и т. п.)
связаны с физ. свойствами металлов, что позволяет строить Ф. п. по экспери
ментальным данным. Напр., магнето-сопротивление металла зависит от того,
открытая Ф. п. или замкнутая, а знак константы Холла (см. Холла эффект) от
того, электронная она или дырочная. Период осцилляции магнитного момента (в
эффекте де Хааза - ван Альфена) определяется экстремальной (по проекции
квазиимпульса на магнитное поле) площадью сечения Ф. п. Поверхностный импеданс
металла в условиях аномального скин-эффекта зависит от средней кривизны
Ф. п. Период (по магнитному полю) осцилляции коэфф. поглощения ультразвука металлом
обратно пропорционален экстремальному диаметру Ф. п. Частота циклотронного
резонанса определяет эффективную массу электрона, знание к-рой
позволяет найти скорость электронов на Ф. п. Для большинства одноатомных
металлов и мн. интер-металлич. соединений Ф. п. уже изучены. Теоретич.
построение Ф. п. основано на модельных представлениях о движении валентных
электронов в силовом поле ионов.
Лит.: Каганов М. И., Филатов А. П., Поверхность Ферми, М., 1969.
М. И. Каганов.
ФЕРМИ ЭНЕРГИЯ, ферми-уровень, значение энергии, ниже к-рой все
энергетич. состояния частиц вырожденного газа, подчиняющихся статистике
Ферми - Дирака (фермионов), при абс. нуле темп-ры заняты (см.
Статистическая физика). Существование Ф. э.- следствие Паули принципа, согласно
к-рому в состоянии с определённым импульсом р не может находиться более (2s +
1) частиц (s - спин частицы). Ф. э. совпадает со значениями химического
потенциала газа фермионов при Т = 0 К. Ф. э. еF можно
выразить через число п частиц газа в единице объёма:
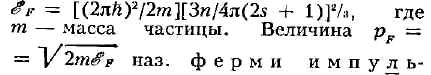
сом , или граничным импульсом. При Т = О К все состояния с импульсами
р<рF заняты частицами, а с р>рр - свободны.
Иными словами, при Т = 0 К фермионы занимают в импульсном пространстве
состояния внутри сферы р2 = 2тeF с радиусом рF
(ферми-сферы).
При нагревании нек-рые частицы переходят из состояния с р < pF
в состояние с р > рF. Внутри ферми-сферы
появляются свободные места, наз.
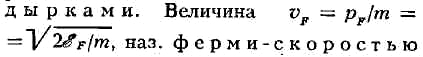
(или граничной скоростью), определяет верхнюю границу скоростей фермионов
при Т = 0 К.
Вырожденный газ электронов проводимости в твёрдом теле при Т = 0 К
заполняет в импульсном пространстве поверхности более сложной формы (см.
Ферми поверхность).
Лит.: Ландау Л.Д.,
Лифшиц Е. М., Статистическая физика, 2 изд., М.,
1964 (Теоретическая физика, т. 5).
М.И. Каганов.