ОНСАГЕРА ТЕОРЕМА, одна из основных теорем термодинамики
неравновесных процессов, установлена в 1931 Л. Онсагером. В
термодинамич. системах, в к-рых имеются градиенты темп-ры, концентраций
компонентов, химич. потенциалов, возникают необратимые процессы
теплопроводности, диффузии, химических реакций. Эти процессы характеризуются
тепловыми и диффузионными потоками, скоростями хим. реакций и т. д. Они наз.
общим термином "потоки" и обозначаются Ji, а вызывающие их
причины (отклонения термодинамич. параметров от равновесных значений) -
термодинамическими силами (Хk). Связь между Jiи Xk,
если термодинамич. силы малы, записывают в виде линейных ур-ний
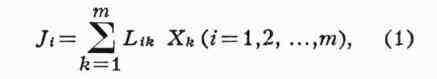
где кинетические коэфф. Lir, определяют вклад различных
термодинамич. сил Xk в создание потока Ji. Соотношения
(1) иногда наз. феноменологическими ур-ниями, a Lik -
феноменологич. коэфф.; значения Lik, рассчитывают или находят
опытным путём. Термодинамич. потоки и силы могут быть скалярами (случай объёмной
вязкости), векторами (теплопроводность, диффузия) и тензорами (сдвиговая
вязкость).
Согласно О. т., если нет магнитного поля и вращения системы как целого, то Lik
= Lki. (2) В том же случае, когда на систему действует внешнее
магнитное поле Н или система вращается с угловой скоростью w,
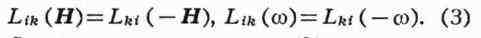
Соотношения симметрии (2) и (3), к-рые иногда называют соотношениями
взаимности Онсагера, устанавливают связь между кинетич. коэфф. при т. н.
перекрёстных процессах (напр., между коэфф. термодиффузии и коэфф. Дюфура
эффекта, обратного термодиффузии). В отсутствие магнитного поля и вращения
эти коэфф. равны между собой, в частности равны кинетич. коэфф. для
перекрёстных химич. реакций.
Лит.: Г р о о т С. Р. д е, Термодинамика необратимых процессов, пер.
с англ., М., 1956; Денбиг К., Термодинамика стационарных необратимых
процессов, пер. с англ., М., 1954; Зубарев Д. Н., Неравновесная статистическая
термодинамика, М., 1971.
П. Н. Зубарев.
ОНСАГЕРА УРАВНЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ, соотношение, показывающее
зависимость электропроводности электролита от его концентрации. О. у. э.
применимо для весьма разбавленных растворов сильных электролитов. В
простейшем случае для полностью диссоциированного одно-одновалентного
электролита (напр., NaCl) О. у. э. имеет вид:
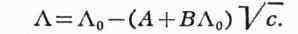
Здесь Л - эквивалентная электропроводность, Ло - эквивалентная
электропроводность при бесконечном разбавлении, с - концентрация в молях на
1 л, А = 82,4/(еТ)1/2n и В = 8,20-105/(еТ)3/2,
где е - диэлектрическая проницаемость, n - вязкость (газ), Т - абс.
темп-pa (К). О. у. э. выведено Л. Онсагером.