МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ, взаимодействие между электрически
нейтральными молекулами или атомами; определяет существование жидкостей и
молекулярных кристаллов, отличие реальных газов от идеальных и проявляется в
разнообразных физич. явлениях. М. в. зависит от расстояния r между
молекулами и, как правило, описывается потенциальной энергией взаимодействия U(r)
(потенциалом М. в.), т. к. именно средняя потенциальная энергия
взаимодействия определяет состояние и многие свойства вещества.
Впервые М. в. принял во внимание Я. Д. ван дер Ваалъс (1873) для
объяснения свойств реальных газов и жидкостей. Ван дер Ваальс предположил, что
на малых расстояниях т между молекулами действуют силы отталкивания,
к-рые с увеличением расстояния сменяются силами притяжения. На основе этих
представлений, даже не рассматривая количественной зависимости М. в. от
расстояния, он получил т. н. Ван-дер-Ваалъса уравнение состояния
реального газа.
М. в. имеет электрич. природу и складывается из сил притяжения
(ориентационных, индукционных и дисперсионных) и сил отталкивания.
Ориентационные силы действуют между полярными молекулами, т. е. обладающими
дипольными электрич. моментами (см. Диполь электрический). Сила
притяжения между двумя полярными молекулами максимальна в том случае, когда их
дипольные моменты располагаются вдоль одной линии (рис. 1). Эта сила возникает
благодаря тому, что расстояния между разноимёнными зарядами немного меньше, чем
между одноимёнными.
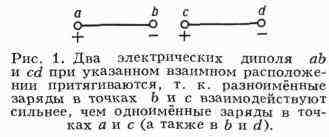
В результате притяжение диполей превосходит их отталкивание.
Взаимодействие диполей зависит от их взаимной ориентации, и поэтому силы
дипольного взаимодействия наз. ориентационными. Хаотич. тепловое движение
непрерывно меняет ориентацию полярных молекул, но, как показывает расчёт, среднее
по всевозможным ориен-тациям значение силы имеет определённую величину, не
равную нулю. Потенциальная энергия ориентационного М. в. Uор(r) ~ р1р2/r6,
где p1 и p2 - дипольные моменты
взаимодействующих молекул. Соответственно сила взаимодействия Fop~ r-7.
Сила Fop убывает с расстоянием значительно быстрей, чем кулоновская сила
взаимодействия заряженных тел
(FКУЛ ~ r-2 ).
Индукционные (или поляризационные) силы действуют между полярной и
неполярной молекулами. Полярная молекула создаёт электрич. поле, к-рое
поляризует молекулу с электрич. зарядами, равномерно распределёнными по объёму.
Положительные заряды смещаются по направлению электрич. поля, а отрицательные —
против. В результате у неполярной молекулы индуцируется дипольный момент.
Энергия М. в. в этом случае пропорциональна дипольному моменту р1
полярной молекулы и поляризуемости а2, характеризующей
способность другой молекулы поляризоваться: Uинд(r) ~ p1a2/r6.
Эта энергия наз. индукционной, т. к. она появляется благодаря поляризации молекул,
вызванной электростатич. индукцией. Индукционные силы (Fинд~r-7) действуют
также и между полярными молекулами.
Между неполярными молекулами действует дисперсионное М. в. Природа этого
взаимодействия была выяснена полностью только после создания квантовой
механики. В атомах и молекулах электроны сложным образом движутся вокруг
ядер. В среднем по времени дипольные моменты неполярных молекул оказываются
равными нулю. Но в каждый момент электроны занимают какое-то положение. Поэтому
мгновенное значение дипольного момента (напр., у атома водорода) отлично от
нуля. Мгновенный диполь создаёт электрическое поле, поляризующее соседние
молекулы. В результате возникает взаимодействие мгновенных диполей. Энергия
взаимодействия между неполярными молекулами есть средний результат
взаимодействия всевозможных мгновенных диполей с дипольными моментами, к-рые
они наводят в соседних молекулах благодаря индукции. Потенциальная энергия
дисперсионного М. в. Uдисп(r)~a1a2/r6,
а Fдисп~r-7 (здесь a1 и a2
- поляризуемости взаимодействующих молекул). М. в. данного типа наз.
дисперсионным потому, что дисперсия света в веществе определяется теми
же свойствами молекул, что и это взаимодействие. Дисперсионные силы действуют
между всеми атомами и молекулами, т. к. механизм их появления не зависит от
того, есть ли у молекул (атомов) постоянные дипольные моменты или нет. Обычно
эти силы превосходят по величине как ориентационные, так и индукционные. Только
при взаимодействии молекул с большими дипольными моментами, напр, молекул воды,
Fop > Fдисп (в 3 раза для молекул воды). При
взаимодействии же таких полярных молекул, как СО, HI, HBr и др., дисперсионные
силы в десятки и сотни раз превосходят все остальные. Очень существенно, что
все три типа М. в. одинаковым образом убывают с расстоянием:
U= Uор+ Uинд +Uдисп~r-6
Силы отталкивания действуют между молекулами на очень малых расстояниях,
когда приходят в соприкосновение заполненные электронные оболочки атомов,
входящих в состав молекул. Существующий в квантовой механике Паули принцип запрещает
проникновение заполненных электронных оболочек друг в друга. Возникающие при
этом силы отталкивания зависят в большей степени, чем силы притяжения, от
индивидуальности молекул. К хорошему согласию с данными экспериментов приводит
допущение, что потенциальная энергия сил отталкивания Uот возрастает
с уменьшением расстояния по закону Uот(r) ~ r-12, а Foт
~ r-13.
Если принять, что U (r) = 0 при r -> оо , и учесть, что
энергия притяжения убывает с уменьшением расстояния пропорционально r-6,
а энергия отталкивания растёт как r-12, то кривая U(r) будет
иметь вид, изображённый на рис. 2. Минимуму потенциальной энергии соответствует
расстояние, на к-ром силы взаимодействия молекул равны нулю.
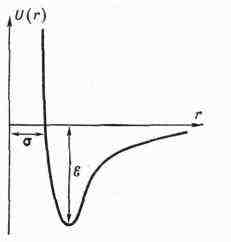
Рис. 2. Зависимость потенциала U(r) межмолекулярного взаимодействия
Леннарда-Джонса от расстояния r между молекулами . Расстояние r =
G - наименьшее возможное расстояние между неподвижными молекулами, E
- глубина «потенциальной ямы» (энергия связи молекул).
Рассчитать с достаточной точностью U(r) на основе квантовой механики
при огромном разнообразии пар взаимодействующих молекул практически нельзя. Не
удаётся пока и экспериментально измерить силу взаимодействия на межмолекулярных
расстояниях. Поэтому обычно подбирают такую формулу для U(r), чтобы
проделанные с её помощью расчёты хорошо бы согласовались с экспериментом.
Наиболее часто пользуются формулой
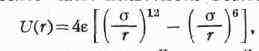
т. н. потенциалом Леннарда-Джонса. Входящие в формулу величины а и е
определяются экспериментально на основе зависимости свойств веществ (напр.,
коэфф. диффузии, теплопроводности или вязкости) от а и е.
Лит.: Радченко И. В., Молекулярная физика, М., 1965; Коулсон К.,
Межатомные силы — от Максвелла до Шредингера, «Успехи физических наук», 19-63,
т. 81, в. 3; Гиршфельдер Дж., Кертисс Ч., БердР., Молекулярная теория газов и
жидкостей, пер. с англ., М., 1961.
Г. Я. Мякишев.