КИРХГОФА ЗАКОН ИЗЛУЧЕНИЯ, закон, утверждающий, что отношение
испускательной способности e (X, Т) тел к их поглощательной способности
а (X, Т) не зависит от природы излучающего тела. Оно равно
испускательной способности абсолютно чёрного тела Е0 (A, Т)
(т. к. его поглощательная способность равна 1) и зависит от длины волны
излучения A и абс. темп-ры Т: e(А,T)/a(A,T) (X, Т). Функция е0(Х,
T) в явном виде даётся Планка законом излучения.
К. з. и. является одним из осн. законов теплового излучения и не
распространяется на др. виды излучения. Он установлен Г. Р. Кирхгофом в
1859 на основании второго начала термодинамики и затем подтверждён
опытным путём. Согласно К. з. и., тело, к-рое при данной темп-ре сильнее
поглощает, должно интенсивнее излучать; напр., при накаливании платиновой
пластинки, часть к-рой покрыта платиновой чернью, её зачернённый конец
светится значительно ярче, чем светлый.
КИРХГОФА ПРАВИЛА, правила, устанавливающие соотношения для токов и
напряжений в разветвлённых электрич. цепях постоянного или квазистационарного
тока. Сформулированы Г. Р. Кирхгофом в 1847. Первое К. п. вытекает
из закона сохранения заряда и состоит в том, что алгебраич. сумма сил токов 1ь,
сходящихся в любой точке разветвления проводников (узле), равна
нулю, т. е.
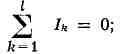
здесь 1 - число токов, сходящихся в данном узле, причём токи, притекающие к
узлу, считаются положительными, а токи, вытекающие из него,- отрицательными
(рис., а). Второе К. п.: в любом замкнутом контуре, произвольно
выделенном в сложной сети проводников (рис., б), алгебраич. сумма всех
падений напряжений hRn на отд. участках контура равна алгебраич. сумме
электродвижущих сил (эдс) Л в этом контуре, т. е.
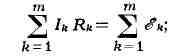
здесь т - число участков в замкнутом контуре (на рис. т - 3),
Ik и Rk, - сила тока и сопротивление участка
номера k; при этом следует выбрать положит. направление токов и эдс,
напр, считать их положительными, если направление тока совпадает с направлением
обхода контура по часовой стрелке, а эдс повышает потенциал в направлении этого
обхода, и отрицательными - при противоположном направлении. Второе К. п.
получается в результате применения Ома закона к различным участкам
замкнутой цепи.
К. п. позволяют рассчитывать сложные электрич. цепи, напр., определять силу и
направление тока в любой части разветвлённой системы проводников, если известны
сопротивления и эдс всех его участков. Для системы из п проводников,
образующих г узлов, составляют п уравнений: r - 1 ур-ние
для узлов на основе первого К. п. (ур-ние для последнего узла не является
независимым, а вытекает из предыдущих) и п - (r - 1) ур-ний
для независимых замкнутых контуров на основе второго К. п.; каждый из п проводников
в эти последние ур-ния должен войти хотя бы один раз. Т. к. при составлении
ур-ний нужно учитывать направления токов в проводниках, а они заранее не
известны (и должны быть найдены из решения системы ур-ний), то сначала
эти направления задаются произвольно; если при решении для к.-н. тока
получается отрицат. значение, то это означает, что его направление
противоположно выбранному.
Лит.: Фриш С. Э. и Тиморева А. В., Курс общей физики, 7 изд., т. 2,
М., 1958, § 169; Калашников С. Г., Электричество, М., 1956 (Общий курс физики,
т. 2), § 79.
КИРХГОФА УРАВНЕНИЕ, равенство, выражающее температурную зависимость
теплового эффекта хим. реакции через разность теплоёмкостей конечных продуктов
и исходных веществ. В частности, для реакций, происходящих при постоянном
объёме, К. у. связывает температурную зависимость изменения внутр. энергии Д[/
при реакции с разностью изохорных теплоёмкостей Со в форме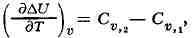
где Cn,i и С„,2 - суммы теплоёмкостей исходных веществ и
продуктов реакции с учётом их стехиометрич. коэффициентов в ур-нии реакции.
Интегрируя это ур-ние, можно определить изменение внутренней энергии АUТ
при интересующей темп-ре Т, если известны АUТ1 при
к.-н. другой темп-ре Ti и теплоёмкости исходных веществ и продуктов
реакции в рассматриваемом температурном интервале. К. у. было выведено Г. Р. Кирхгофом
в 1858.
В. А. Киреев.
КИРХЕНШТЕЙН Август Мартынович [6(18).9.1872, Мазсалаца, ныне
Валмиерского р-на Латв. ССР,- 3.11.1963, Рига], советский гос. деятель,
учёный-микробиолог, акад. АН Латв. ССР (1946), Герой Социалистич. Труда
(1957). Чл. КПСС с 1941. Род. в крест, семье. Окончил Юрьевский вет.
ин-т (1902). За революц. деятельность в 1905 подвергался репрессиям, в
том же году эмигрировал за границу. В 1917 вернулся в Латвию, принимал участие
в революц. движении. Занимался науч.-пед. работой, был одним из организаторов
Латв. ун-та и с.-х. академии. С 1923 проф. кафедры микробиологии Латв. ун-та. В
1940 премьер-министр нар. пр-ва и президент Латвии. После установления Сов.
власти в 1940-52 пред. Президиума Верх. Совета Латв. ССР, зам. пред.
Президиума Верх. Совета СССР (1941-52); одновременно с 1946 директор
Ин-та микробиологии АН Латв. ССР. В 1951-1958 вице-президент АН Латв.
ССР. Осн. труды в области микробиологии и витаминологии. Награждён 6 орденами
Ленина, 4 др. орденами, а также медалями.
КИРХНЕР (Kirchner) Эрнст Людвиг (6.5.1880, Ашаффенбург,
Бавария, - 15.6.1938, Фрауэнкирх, близ Давоса, Швейцария), немецкий
живописец и график. Учился архитектуре в Высшей технич. школе в Дрездене
(1901-05). Живописи учился самостоятельно. Один из первых практиков и
теоретиков экспрессионизма. В 1905 совм. с Э. Хеккелем и К.
Шмидт-Ротлуфом основал объединение "Мост". С 1915 жил в Швейцарии.
После прихода нацистов к власти исключён из Прусской АХ (чл. с 1931), а
его работы изъяты из нем. музеев. Покончил с собой.
Лит.:
Gordon
D. E., E. L. Kirchner, Camb. (Mass.), 1968.
КИРШ Карл Васильевич [27.8(8.9). 1877-13.12.1919], русский учёный в
области теплотехники, профессор. В 1901 окончил Моск. высшее технич. уч-ще и
остался работать там. С 1906 начал читать курс заводских топок и котельных
установок. С 1910 зав. лабораторией котлов. В 1907 предложил метод расчёта
паровых котлов, послуживший впоследствии основой для тепловых расчётов
котельных агрегатов. Провёл ряд исследований по вопросу пром. использования
местных топлив и отходов.
Соч.: Котельные установки, ч. 1 - 2, М., 1926 - 30;
Антрацит, как топливо котельных, М., 1925.
КИРША ДАНИЛОВ, Кирилл Данилович, скоморох-импровизатор, вероятный
составитель первого сборника русских былин, исторических, лирических песен, духовных
стихов (71 текст с нотами). На Урале после 1742 записал свой
репертуар. Оригинал сборника К. Д. имел с 1768 рус. заводчик П. А. Демидов.
Сохранилась копия на бумаге 60-80-х гг. 18 в. Первые издания сборника -
"Древние русские стихотворения" (под ред. А. Ф. Якубовича, 1804),
"Древние российские стихотворения" (под ред. К. Ф. Калайдовича, 1818).
Сборник, открывший рус. лит-ре 19 в. былевой эпос, высоко ценили А. С. Пушкин,
В. Г. Белинский, Ф. М. Достоевский, М. Горький.
Изд.: Сборник Кирши Данилова... [Под ред. П. Н. Шеффера], СПБ, 1901; Древние
российские стихотворения, собранные Киршею Даниловым. [Изд. подготовили
А. П. Евгеньева и Б. Н. Путилов], М.- Л., 1958.
Лит.: Азадовский М. К., История русской фольклористики, т. 1, М.,
1958, с. 85, 103-04, 165, 168-73; Дергачева-Скоп Е. И., Новонайденные листы
из сборника Кирши Данилова, "Труды Отдела древнерусской литературы",
1965, т. 21.
А. А. Горелов.
КИРШОН Владимир Михайлович [6(19).8.1902-28.7.1938], русский
советский драматург. Чл. КПСС с 1920. Род. в г. Нальчик. Участник Гражд. войны
1918-20. Окончил Коммунястич. ун-т им. Я. М. Свердлова в Москве (1923).
Был одним из руководителей РАПП и ВОАПП. Автор пьес: "Константин
Терёхин" ("Ржавчина", в соавторстве с А. Успенским, 1927),
"Рельсы гудят" (1928), "Город ветров" (1929),
"Хлеб" (1930), "Суд" (1933), "Чудесный
сплав" (1934), "Большой день" (1936). Для
драматургии К. характерны актуальность и острота социальной проблематики. В гл.
героях его пьес воплощён тип нового руководителя, стойкого большевика-ленинца.
Произв. К. переведены на иностр. яз. и языки народов СССР.
Соч.: Драматические произведения, М., 1957; Избранное, М., 1958; Статьи и
речи о драматургии, театре и кино. Пьесы В. М. Киршона на сцене. Воспоминания о
В. М. Киршоне, М., 1962; О литературе и искусстве. Статьи и выступления, М.,
1967 (библ.).
Лит.: Луначарский А. В., Собр. соч. в 8 тт., т. 2, М., 1964, с. 544 -
51, т. 3, М., 1964, с. 433-38; Горький и советские писатели. Неизданная
переписка, в кн.: Литературное наследство, т. 70, М., 1963; Тамашин Л.,
Владимир Киршон. Очерк творчества, М., 1965.
Э. А. Полоцкая.
КИРЮ, город в Японии, в центр, части о. Хонсю, на р. Ватарасе, в
префектуре Гумма. 133 тыс. жит. (1970). Ж.-д. узел. Один из древнейших и
крупнейших в стране центров произ-ва изделий из шёлка. Пищ. пром-сть. З-д по произ-ву весов-автоматов и оборудования для торг. сети.
КИРЯ, посёлок гор. типа в Алатырском р-не Чуваш. АССР. Ж.-д. станция
на линии Канаш - Рузаевка. Лесокомбинат.
КИСАНГАНИ (Kisangani) (до 1966 - Стэнливиль), город в
Республике Заир; адм. центр пров. Верхний Заир. 229,6 тыс. жит. (1970).
Порт на р. Конго (Заир) ниже водопадов Стэнли, начальный пункт
судоходства по ср. течению р. Конго до г. Киншаса; связан ж. д. в обход
водопадов Стэнли с портом Убунду на р. Луалаба. Узел автодорог; аэропорт
междунар. значения. Важный торг.-распределит, и пром. центр. Первичная
обработка с.-х. сырья (очистка хлопка, риса и др.), предприятия пищ. (в
т. ч. пивоваренной), хим., деревообр. пром-сти; произ-во
стройматериалов. Осн. в 1883 Г. Стэнли, по имени к-рого получил своё название
вначале.
КИСЕГАЧ, климато-бальнеологический и грязевой курорт РСФСР, в 90 км
от Челябинска и 6 км от ж.-д. ст. Чебаркуль на линии Уфа -
Челябинск. Расположен на Юж. Урале, на перешейке озёр Большой Кисегач и Малый
Геренкуль. Лето умеренно тёплое (ср. темп-pa июля ок. 18 °С), зима
умеренно холодная (ср. темп-pa янв. -16 °С); осадков 630 мм в
год. Леч. средства: сапропелевая грязь оз. Боляш, искусств, минеральные ванны
(углекислые, сероводородные, радоновые). Лечение больных с заболеваниями
органов движения и опоры, нервной системы и кровообращения. Санаторий,
водолечебница, грязелечебница, аэросолярий. Вблизи К.- санаторий для больных
активными формами туберкулёза лёгких.
КИСЕЛЁВ Александр Александрович [6(18).6.1838, Свеаборг, ныне
Суоменлинна, Финляндия, - 20.1 (2.2). 1911, Петербург], русский пейзажист.
Учился в петерб. АХ (1861-65); действит. чл. с 1893, проф.-руководитель
пейзажной мастерской с 1897. Чл. Т-ва передвижных художеств, выставок (см. Передвижники;
с 1876). Пейзажи К. отличаются повествовательностью и тщательной
выписанностью деталей ("С горы", 1866, "Старый Сурамский
перевал", 1891,оба в Третьяковской гал.). Выступал также как художеств,
критик.
Лит.: Академик живописи А. А. Киселев, М., [1913]; Мальцева Ф. С.,
Мастера русского реалистического пейзажа, в. 2, М., 1959, с. 142-145.
КИСЕЛЁВ Алексей Семёнович (1879 - 30.10.1937), советский гос. и парт,
деятель. Род. в с. Авдотьино, ныне Владимирской обл., в семье рабочего;
слесарь. Чл. Коммунистич. партии с 1898. В Революцию 1905-07 чл. Иваново-Вознесенского
к-та, чл. Сокольнического (Москва) районного к-та РСДРП. Вёл парт, работу в
Петербурге, Харькове, Баку, Одессе и ряде городов Сибири. В 1914 кооптирован в
ЦК партии. Неоднократно подвергался репрессиям. После Февр. революции 1917
пред. гор. Совета и чл. Иваново-Вознесенского к-та РСДРП(б). На 1-м Всеросс.
съезде Советов (июнь 1917) избран чл. ВЦИК. На 6-м съезде РСДРП(о) избран канд.
в чл. ЦК. После Окт. революции 1917 пред. Центротекстиля, чл. Президиума ВСНХ,
затем чл. комиссии СНК по делам Туркестана. В 1918 нач. группы обороны
Оренбурга от войск Колчака и Дутова. В 1920 пред, союза горнорабочих. В 1921-23
пред. Малого СНК, со 2-го Всесоюзного съезда Советов (янв.- февр. 1924) чл. ЦИК
СССР. На 12-м съезде РКП(б) (1923) избран чл. ЦКК РКП(б); был чл. Президиума
ЦКК, наркомом РКИ РСФСР и зам. наркома РКИ СССР. На 7, 10, 11, 14-16-м съездах
партии избирался канд. в чл. ЦК, на 17-м- чл. Центр, ревизионной комиссии. С
1924 был секретарём ВЦИК и чл. Президиума ВЦИК; чл. ЦИК СССР и чл. Президиума ЦИК
СССР.
КИСЕЛЁВ Андрей Петрович [30.11 (12.12). 1852, Мценск, ныне Орловской
обл.,- 8.11.1940, Ленинград], русский педагог-математик. После окончания (1875)
физико-математич. ф-та Петерб. ун-та работал (до июля 1891) преподавателем
математики, механики и черчения в Воронежском реальном уч-ще, затем в
Воронежском кадетском корпусе (до 1901), после чего вышел в отставку. В 1884 К.
издал "Систематический курс арифметики для ср. уч. заведений", в 1888
-"Элементарную алгебру", в 1892 "Элементарную геометрию". Эти
книги отличались от существовавших в то время учебников более высоким теоретич.
уровнем, последовательностью, ясностью и краткостью изложения. Они стали осн.
учебниками по математике в ср. уч. заведениях.
После Великой Окт. революции К. вернулся к преподават. деятельности,
одновременно продолжал работать над совершенствованием своих учебников. В сов.
время учебники арифметики, алгебры и геометрии К. неоднократно переиздавались и
20 лет были стабильными учебниками в ср. школе ("Арифметика", 17
изд., 1955; "Алгебра", ч. 1, 1954-55; ч. 2, 42 изд., 1965;
"Геометрия", ч. 1, 21 изд., 1962; ч. 2, 31 изд., 1970). Награждён
орденом Трудового Красного Знамени.
Лит.: Андронов И. К., А. П. Киселев. [Некролог], "Математика в
школе", 1941, №2; Маргулис А. Я., Андрей Петрович Киселев, там же, 1948, №
4: Депман И. Я., История арифметики, М., 1959.
КИСЕЛЁВ Павел Дмитриевич [8(19). 1.1788, Москва,- 14(26).11.1872,
Париж], граф, русский гос. деятель. Участник Отечеств, войны 1812. С 1814
флигель-адъютант имп. Александра I. В 1816 представил царю записку о
постепенном освобождении крестьян от крепостной зависимости. С 1819 нач. штаба
2-й армии, расквартированной на Украине. Был близок с членами Южного
общества декабристов, особенно с П. И. Пестелем, но о существовании
общества не знал. После рус.-тур. войны 1828-29 К. было поручено управление
Молдавией и Валахией, где он провёл ряд прогрессивных реформ. С 1835 постоянный
чл. всех секретных к-тов по крест, делу. В 1835 секретным к-том под рук. К.
выработан план постепенной ликвидации крепостного права (личное освобождение
крестьян и гос. регулирование крест, наделов и повинностей), к-рый
встретил сопротивление помещиков-крепостников. С 1837 министр гос. имуществ; в
1837-41 провёл реформу управления государственными крестьянами. Приходские
уч-ща, созданные в селениях гос. крестьян, стали наз. "Киселевские"
школы. В 1856-62 рус. посол в Париже, с 1862 в отставке.
Лит.: Дружинин Н. М., Государственные крестьяне и реформа П. Д.
Киселева, т. 1 - 2, М.- Л., 1946 - 58; 3аблоцкий-Десятовский А. П., Граф
П. Д. Киселев и его время, т. 1-4, СПБ, 1882.
Н. М. Дружинин.
КИСЕЛЁВ Сергей Владимирович [4(17).7.1905, Мытищи, ныне
Московской обл.,- 8.11.1962, Москва], советский археолог и историк,
чл.-корр. АН СССР (1953), специалист по археологии бронз, века, а также
древней и ср.-век. истории народов Юж. Сибири и Монголии. Чл. КПСС с 1949. В
1926 окончил Моск. ун-т. С 193.0 старший научный сотрудник Гос. академии
истории материальной культуры (ныне Ин-т археологии АН СССР), с 1939
проф. Моск. ун-та; в 1949-62 гл. редактор журн. "Вестник древней
истории". С 1927 вёл археол. исследования на Алтае, в Хакассии, Туве,
Центр. Казахстане, результаты к-рых обобщены в труде "Древняя история
Южной Сибири" (1949), удостоенном в 1950 Гос. пр. СССР. В 1948-49
руководил сов.-монг. экспедицией (раскопки древних городов Хара-Балгас и
Каракорум);
в 1957-61 в Забайкалье исследовал Кондуйский дворец, г. Хирхира и др. Эти
работы подтвердили существование др.-монг. городов (см. сб.
"Древнемонгольские города", 1965). Награждён орденом Ленина и
орденом "Знак Почёта".
Лит.: С. В. Киселев, "Вестник древней истории", 1963, № 1;
Новое в советской археологии, М., 1965 (биография и список печатных трудов С.
В. Киселева).
КИСЕЛЁВ Тихон Яковлевич [р. 30.7 (12.8).1917, дер. Огородил, ныне
Добрушского р-на Гомельской обл.], советский гос. и парт, деятель. Чл. КПСС с
1940. Род. в крест, семье. Окончил Речицкое пед. уч-ще (1936), заочно
Гомельский пед. ин-т (1941). Работал учителем, директором школы. С 1944
инструктор Гомельского обкома КП(б) Белоруссии. После окончания в 1946 Высшей
парт, школы при ЦК ВКП(б) зав. лекторской группой Брестского обкома партии. В
1948-52 зав. отделом школ Управления пропаганды и агитации, зам. зав., зав.
отделом пропаганды и агитации ЦК КП(б) Белоруссии. В 1952-55 первый секретарь
Брестского обкома партии. В 1955-56 секретарь, в 1956-59 второй секретарь ЦК КП
Белоруссии. В 1958-62 зам. пред. Совета Национальностей Верх. Совета СССР. С
апр. 1959 пред. Сов. Мин. БССР. На 22-24-м съездах КПСС избирался чл. ЦК КПСС.
Деп. Верх. Совета СССР 4-8-го созывов. Награждён 2 орденами Ленина, орденом
"Знак Почёта" и медалями.
КИСЕЛЁВ Яков Семёнович [р. 15(27). 11.1896, Екатеринослав, ныне
Днепропетровск], советский адвокат. Участник Гражданской войны 1918-20. Окончил
МГУ (1922). С 1923 занимается адвокатской деятельностью, с 1924 чл.
Ленинградской гор. коллегии адвокатов, неоднократно избирался в её Президиум.
К.- автор работ, посвящённых сов. адвокатуре. Награждён орденом Трудового
Красного Знамени и медалями.
Соч.: Судебные речи. Л., 1967.
КИСЕЛЁВА РЕФОРМА. реформа управления государственными крестьянами в
России, проведённая в 1837-41 под руководством министра гос. имуществ П. Д. Киселёва.
КИСЕЛЁВСК, город в Кемеровской обл. РСФСР. Расположен в предгорьях
Салаирского кряжа, в верховьях р. Аба. Ж.-д. станция в 58 км к С.-З. от
Новокузнецка. 125 тыс. жит. в 1972 (44 тыс. в 1939). Важный центр добычи
угля в Кузнецком угольном басс. 3-ды угольного машиностроения, углеобогатит.
ф-ки, кирпичный з-д, обувная, мебельная и кондитерская ф-ки, пивоваренный з-д.
Горный техникум, пед. уч-ще. К. возник в годы Сов. власти на месте деревень
Черкасове и Афонино; город с 1936.
Лит.: А г е е в Н. К., Киселевск, Кемерово, 1972.
"КИСЕЛЕВСКИЕ" ШКОЛЫ, сельские приходские уч-ща в
России, создававшиеся по инициативе министра гос. имуществ П. Д. Киселёва в
селениях гос. крестьян. Улучшение крест, х-ва Киселёв неразрывно связывал с
распространением начального школьного образования. Указом от 27 июня 1842 было
предписано учредить в казённых селениях сел. приходские уч-ща на основе Устава
1828 об учреждении приходских уч-щ. Согласно указу, цель "К." ш.
заключалась в "распространении и утверждении между государственными
крестьянами религиозно-нравственного образования и первоначальных, более или
менее для каждого сословия нужных сведений". В 1843 были
опубликованы "Наставления для управления сельскими приходскими училищами в
селениях государственных крестьян". Обучение в "К." ш. сводилось
к изучению закона божия, грамоты и первых четырёх действий арифметики.
Дополнительно вводилось церк. пение и занятие садоводством и огородничеством. В
школы допускались дети 8 лет (могли обучаться и девочки); обучение
происходило зимой, когда не было полевых работ. "К." ш. устраивались
в центр, селении каждой волости и содержались за счёт дополнит, обложений
крестьян. Преподавание в школах возлагалось на сел. священников.
Открытие "К." ш. в деревнях встретило, особенно в первое время,
сочувственное отношение крестьян. Но вскоре злоупотребления администрации и
духовенства и сама постановка обучения изменили отношение крестьян к
"К." ш. В 1866-67, в связи с выходом гос. крестьян из подчинения
Мин-ву гос. имуществ, часть "К." ш. была передана в ведение земств, а
часть - Мин-ву нар. просвещения.
Лит.: Заблоцкий-Десятовский А. П., Граф П. Д. Киселев и его время,
т. 1 - 4, СПБ, 1882; Дружинин Н. М., Государственные крестьяне и реформа П. Д.
Киселёва, т. 2, М., 1958.
Э. Д. Днепров.
КИСЕЛИНЧЕВ Асен Христов (13.9. 1905, София,- 3.2.1960, там же),
болгарский философ-марксист, психолог и педагог, акад. Болг. АН (1958).
Чл. БКП с 1927. В 20-30-х гг. сотрудничал в марксистской печати. Участвовал в
антифашистской борьбе. Проф. и зав. кафедрой психологии, логики и этики
Софийского ун-та (с 1951), директор Ин-та философии Болг. АН (с 1952).
В 1957-59 зам. министра просвещения и культуры. Осн. работы по проблемам
психологии, педагогики, философии, филос. проблемам биологии. Выступал с
критикой фаш. идеологии. Пр. им. Димитрова (1950, 1959).
Соч.: Избрани произведения в 3 тома, т. 1 - 2, София, 1964 - 67; в рус.
пер.Марксистско-ленинская теория отражения и павловское учение о высшей нервной
деятельности, М., 1956.
КИСЕЛЬ Александр Андреевич [19(31). 8.1859, Киев, - 8.3.1938,
Москва], советский педиатр, засл. деят. науки РСФСР (1933). В 1883
окончил мед. ф-т Киевского ун-та. С 1910 преподавал, был проф. и директором
детской клиники Высших женских курсов (с 1930 - 2-й Моск. мед. ин-т) и
одновременно (с 1927) - науч. руководитель Центр, ин-та охраны
здоровья детей и подростков (ныне Моск. н.-и. ин-т педиатрии и детской хирургии
Мин-ва здравоохранения РСФСР). Осн. работы по проблемам туберкулёза,
ревматизма, малярии, острых детских инфекций и др. Создал учение о хронич.
туберкулёзной интоксикации у детей. Организовал первую в СССР ревматич.
клинику. Пропагандировал профилактику мн. заболеваний при помощи физич. методов
лечения (солнечный свет, воздух) и оздоровления внеш. среды.
Соч.: Труды заслуженного деятеля науки профессора А. А. Киселя, т. 1 - 2,
М.- Л., 1940-44.
Лит.: Конюс Э. М., А. А. Кисель и его школа, М., 1949 (библ.).
КИСИ Нобусукэ (р.13.11.1896, префектура Ямагути), японский гос. и
политич. деятель. В окт. 1941 - окт. 1943 мин. торговли и пром-сти, в окт. 1944
- сент. 1945 гос. министр. После капитуляции Японии во 2-й мировой войне
1939-45 арестован как воен. преступник, в дек. 1948 освобождён без суда амер.
оккупац. властями. В дек. 1956 мин. иностр. дел, в февр. 1957 - июне 1960
президент Либерально-демократич. партии (ЛДП) и премьер-министр. Пр-во К.
стремилось всячески ограничить демократич. права народа, усиливало
ремилитаризацию и проводило курс на дальнейшее укрепление воен.-политич. союза
с США. Заключение в янв. 1960 пр-вом К. японо-амер. "договора безопасности"
вызвало в стране взрыв возмущения. В результате массового нар. движения пр-во
К. было вынуждено в июне 1960 подать в отставку. После ухода в отставку К.
продолжал оказывать большое влияние на определение курса ЛДП.
КИСИ, г и и, а с с и, народ в Зап. Африке. Населяет главным образом
прибрежные районы и окрестности г. Фритауна в Сьерра-Леоне, а также терр.
кС.-З. от г. Конакри в Гвинейской Республике; небольшая часть живёт в Либерии,
у границы с Сьерра-Леоне. Численность вместе с близкородственными народами
булом, темне, лимба, бага и ландума ок. 2 млн. чел. (1970, оценка). Язык
- киси, относится к группе атлантических западных языков. Религия -
культы сил природы, часть К. исповедует ислам. Осн. занятие - земледелие
(арахис, просо, ямс), на побережье - рыболовство; развито отходничество
на транспорт и на пром. предприятия Фритауна, Бо и др. городов Сьерра-Леоне.
КИСИВАДА, город в Японии, на юге о. Хонсю, в префектуре Осака. 162
тыс. жит. (1970). Лесовывозящий порт на берегу Внутреннего Японского м.
Переработка с.-х. и мор. продуктов. Предприятия текст, (хл.-бум.), хим.
и металлообр. пром-сти.
КИСИМАЙО, Кисмаю (Chisimaio, Kismayu), город и порт на берегу
Индийского ок., на Ю. Сомалийской Республики. Адм. центр обл. Ниж. Джуба. Ок.
30 тыс. жит. Связан автодорогой с г. Могадишо. Вывоз бананов, скота, кож.
сырья, рыбы. Мясокомбинат, построенный с помощью СССР.
КИСЛИЦА (Oxalis), род растений сем. кисличных. Многолетние,
реже однолетние травы, иногда полукустарники с очередными, б. ч. тройчато- или
пальчатосложными листьями. Цветки пятичленные. Плод - коробочка. Ок. 800 видов,
гл. обр. в Юж. Африке, Юж. Америке и Мексике. В СССР 6 видов. В тенистых
хвойных лесах часто встречается К. обыкновенная, или заячья капуста (О.
acetosella),- маленькое бесстебельное растение с ползучим корневищем.
Листочки её тройчатых листьев ночью и в пасмурную погоду складываются. Цветки
одиночные белые с розово-фиолетовыми жилками. Листья её,как и К. рожковой (О.
corniculata), содержат витамин С и щавелевую к-ту; в большом кол-ве
ядовиты для овец. Нек-рые афр. и амер. виды в ряде стран культивируют ради
съедобных клубней. Мн. виды разводят как декоративные.
КИСЛИЧНИК (Oxyria), род растений сем. гречишных. Многолетние
травы с ползучим корневищем и прикорневыми почковидными листьями на длинных
черешках. Цветки обоеполые, в метёлке.
Околоцветник 4-членный; тычинок 6; плод - крылатый орешек. Известно 2-3 вида
в Евразии и Сев. Америке; растут в арктич. зоне и в альпийском поясе гор, у
ручьёв и родников, на галечниках и каменистых склонах. В СССР в тундре и горах
Сибири и Д. Востока произрастает К. двухстолбчатый (О. digyna), а в
горах Кавказа и Ср. Азии - К. пружинистый (О. elatior). Листья К. кислые
на вкус, богаты витамином С.
КИСЛОВОДСК, город в Ставропольском крае РСФСР, один из крупнейших в
СССР бальнео-климатич. курортов в группе Кавказских Минеральных Вод. Конечная
ж.-д. станция ветки (64 км) от Минеральных Вод. 91 тыс. жит. в 1972 (22
тыс. в 1926; 51 тыс. в 1939). Расположен в сев. предгорьях Б. Кавказа на
выс. 720-1060 м, в долинах горных рек Ольховка и Берёзовка (бассейн р.
Подкумок); окружён горами.
Лето тёплое (ср. темп-pa июля 19 °С), зима умеренно мягкая (ср.
темп-ра янв. -3,9 °С) с сухой, ясной, безветренной погодой и обилием
солнца; осадков ок. 600 мм в год. Леч. средства: углекислая
гидрокарбонатно-сульфатная кальциево-натриевая вода источника
"Нарзан" с хим. составом
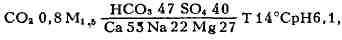
используемая для ванн и розлива (имеется з-д). Для питьевого лечения
применяют минеральные воды источников "Доломитный Нарзан" с хим.
составом
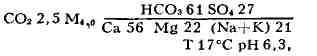
"Сульфатный Нарзан"
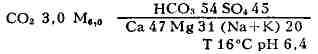
и воды буровой скважины № 23 с хим. составом
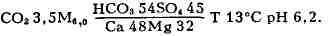
По 43-км трубопроводу из Кумского месторождения в нос. Красный Восток
Карачаево-Черкесской АО в К. подаётся углекислая вода, близкая по составу к
ессентукским нарзанам. Лечение больных с заболеваниями органов кровообращения,
органов дыхания нетуберкулёзного характера, мочевыводящих путей, нарушениями
обмена веществ и сопутствующими им заболеваниями органов пищеварения. Большой
популярностью в К. пользуются терренкур (от Нарзанной галереи на Красные
камни, Серые камни, Синие камни, Сосновую горку, Красное солнышко, Храм воздуха
и др.) и т. н. ближний туризм (скала Лермонтова, Кольцо-гора, скала
Замок, Долина очарования, горы Б. и М. Седло, Джинал, Бермамыт и др.).
К. возник из военного укрепления и станицы Терского казачьего войска,
основанной в 1803 (с 1830 - город).
Интенсивная застройка К. началась уже в 19 в.: были сооружены деревянные
купальни (1812), ресторан с залом для танцев и помещения для приезжающих
(1823), ванны (1827-32; 1901-04, арх. А. Н. Клепинин), нарзанная
гал. (1848-58, арх. С. П. Уптон, псевдоготика), курзал (1895, эклектич.
подражание позднему ренессансу). Большое стр-во ведётся в сов. время. По
ген. планам Кисловодск. Вверху: столовая и клуо санатория
"Пикет" (1971, арх, С. Д. Турчанинов); внизу; на первом
плане-санаторий "Россия" (1936, арх. П. П. Еськов; ныне 2-е отделение
санатория им. Кирова); на втором плане - санаторий "Горные вершины"
(1951, арх. Н. С. Полюдов; с 1963 в составе санатория имени Г. К.
Орджоникидзе). С развития и благоустройства города (1934, арх. В. Н. Семёнов и
др.; новый план - 1968) проведена реконструкция улиц, упорядочено озеленение
(площадь зелёных насаждений более 2 тыс. га), застраиваются новые р-ны,
построены многочисленные здравницы, среди которых - санаторий им. Г. К.
Орджоникидзе (1935-37, арх. М. Я. Гинзбург, С. Е. Вахтангов, И. И. Леонидов, Е.
М. Попов, И. И. Шпалек и др.; илл. см. т. 6, стр. 530), "Горные
вершины" (1951, арх. Н. С. Полюдов; с 1963 в составе санатория им. Г. К.
Орджоникидзе), санаторий для военных (1956, арх. Б. Г. Бархин, Н. И. Гайгаров);
выстроены кинотеатр "Россия" (типовой проект; 1970, авторы привязки
арх. И. М. Фриденталь, П. Т. Федонюк, инж. И. П. Лапченко и др.), гор. узел
связи (1970, арх. М. П. Константинов). Памятник В. И. Ленину (барельеф; бронза,
1925, скульптор В. А. Андреев).
В К.- мед. уч-ще; художеств, музей Н. А. Ярошенко; туристская база,
пансионаты.
Лит.: Хибаров М. И., Кисловодск - город солнца, М., 1969; Покровский
С. И., Кисловодский терренкур. Ближний туризм, Ставрополь, 1970.
КИСЛОВОДСКАЯ ГОРНАЯ АСТРОНОМИЧЕСКАЯ СТАНЦИЯ Главной астрономической
(Пулковской) обсерватории АН СССР, н.-и. учреждение, расположенное на высоте
2070 м, вблизи г. Кисловодска. Осн. в 1948. Основные задачи: регулярные
наблюдения и исследования активных процессов в фотосфере, хромосфере и короне
Солнца оптич. и радиометодами с целью исследования как самой солнечной
активности, так и её воздействий на ионосферу, магнитосферу, тропосферу и
биосферу Земли. К. г. а. с., являясь ведущим научным учреждением в сети
обсерваторий Службы Солнца СССР, собирает, контролирует и сводит в единую
систему данные всей сети и готовит их для публикаций, распространяет информацию
о состоянии солнечной активности, ведёт взаимный обмен информацией с
аналогичными зарубежными обсерваториями. Научное оборудование: коронографы с
объективами диаметром 53 и 20 см, хромосферно-фотосферный телескоп,
горизонтальный телескоп с большим спектрографом, спектрогелиограф,
радиотелескопы для волн 2,5 и 150 см. Публикации: бюллетень
"Солнечные данные" (ежемесячно), Каталог солнечной
деятельности (ежегодно).
Лит.: Гневышев М. Н., Кисловодская горная астрономическая станция,
М.Л., 1965.
М. Н. Гневышев.
КИСЛОРОД (лат. Oxygenium), О, хим. элемент VI группы периодич.
системы Менделеева; ат. номер 8, ат. масса 15,9994. При нормальных условиях
К.газ без цвета, запаха и вкуса. Трудно назвать другой элемент, к-рый играл бы
на нашей планете такую важную роль, как К.
Историческая справка. Процессы горения и дыхания издавна привлекали внимание
учёных. Первые указания на то, что не весь воздух, а лишь "активная"
его часть поддерживает горение, обнаружены в кит. рукописях 8 в. Много позже
Леонардо да Винчи (1452-1519) рассматривал воздух как смесь двух газов,
лишь один из к-рых расходуется при горении и дыхании. Окончательное открытие
двух главных составных частей воздуха - азота и К., сделавшее эпоху в
науке, произошло только в конце 18 в. (см. Химия, Исторический очерк).
К. получили почти одновременно К. Шееле (1769-70) путём
прокаливания селитр (KNO3, NaNO3), двуокиси
марганца МnО2 и др. веществ и Дж. Пристли (1774) при
нагревании сурика Рb3О4 и окиси ртути HgO. В 1772 Д. Резерфорд
открыл азот. В 1775 А. Лавуазье, произведя количественный анализ
воздуха, нашёл, что он "состоит из двух (газов) различного и, так сказать,
противоположного характера", т. е. из К. и азота. На основе широких
экспериментальных исследований Лавуазье правильно объяснил горение и дыхание
как процессы взаимодействия веществ с К. Поскольку К. входит в состав кислот,
Лавуазье назвал его oxygene, т. е. "образующий кислоты" (от греч.
oxys - кислый и gennao - рождаю; отсюда и русское название "кислород").
Распространение в природе. К.- самый распространённый хим. элемент на Земле.
Связанный К. составляет около "/? массы водной оболочки Земли - гидросферы
(85,82% по массе), почти половину литосферы (47% по массе), и
только в атмосфере, где К. находится в свободном состоянии, он занимает второе
место (23,15% по массе) после азота.
К. стоит на первом месте и по числу образуемых им минералов (1364);
среди минералов, содержащих К., преобладают силикаты (полевые шпаты, слюды и
др.), кварц, окислы железа, карбонаты и сульфаты. В живых организмах в
среднем ок. 70% К.; он входит в состав большинства важнейших органич.
соединений (белков, жиров, углеводов и т. д.) и в состав неорганич. соединений
скелета. Исключительно велика роль свободного К. в биохимич. и физиол.
процессах, особенно в дыхании. За исключением нек-рых
микроорганизмов-анаэробов, все животные и растения получают необходимую для
жизнедеятельности энергию за счёт окисления биологического различных
веществ с помощью К.
Вся масса свободного К. Земли возникла и сохраняется благодаря
жизнедеятельности зелёных растений суши и Мирового ок., выделяющих К. в
процессе фотосинтеза. На земной поверхности, где протекает фотосинтез и
господствует свободный К., формируются резко окислительные условия. Напротив, в
магме, а также глубоких горизонтах подземных вод, в илах морей и озёр, в
болотах, где свободный К. отсутствует, формируется восстановит, среда.
Окислительно-восстановит. процессы с участием К. определяют концентрацию многих
элементов и образование месторождений полезных ископаемых - угля, нефти, серы,
руд железа, меди и т. д. (см. Круговорот веществ). Изменения в
круговорот К. вносит и хоз. деятельность человека. В нек-рых пром. странах при
сгорании топлива расходуется К. больше, чем его выделяют растения при
фотосинтезе. Всего же на сжигание топлива в мире ежегодно потребляется ок. 9-109
т К.
Изотопы, атом, молекул а. К. имеет три устойчивых изотопа: 16О, 17О
и 18О, среднее содержание которых составляет соответственно 99,759%,
0,037% и 0,204% от общего числа атомов К. на Земле. Резкое преобладание в смеси
изотопов наиболее лёгкого из них 16О связано с тем, что ядро атома 16О
состоит из 8 протонов и 8 нейтронов. А такие ядра, как следует из теории
атомного ядра, обладают особой устойчивостью.
В соответствии с положением К. в периодической системе элементов Менделеева
электроны атома К. располагаются на двух оболочках: 2 - на внутренней и 6 - на
внешней (конфигурация Is22s22p4; см. Лтом).
Поскольку внеш. оболочка атома К. не заполнена, а потенциал ионизации и
сродство к электрону составляют соответственно 13,61 и 1,46 эв, атом К.
в хим. соединениях обычно приобретает электроны и имеет отрицательный
эффективный заряд. Напротив, крайне редки соединения, в к-рых электроны
отрываются (точнее оттягиваются) от атома К. (таковы, напр., F2O,
Р2Оз). Раньше, исходя единственно из положения К. в периодич.
системе, атому К. в окислах и в большинстве др. соединений приписывали
отрицательный заряд (-2). Однако, как показывают экспериментальные
данные, ион О2- не существует ни в свободном состоянии, ни в
соединениях, и отрицательный эффективный заряд атома К. практически никогда
существенно не превышает единицы.
В обычных условиях молекула К. двухатомна (О2); в тихом
электрич. разряде образуется также трёхатомная молекула Оз - озон; при высоких
давлениях обнаружены в небольших количествах молекулы О4 Электронное
строение О2 представляет большой теоретич. интерес. В основном
состоянии молекула О2 имеет два неспаренных электрона; для неё
неприменима "обычная" классич. структурная формула О = О с двумя
двухэлектронными связями (см. Валентность). Исчерпывающее объяснение
этого факта дано в рамках теории молекулярных орбиталей. Энергия ионизации
молекулы К. (О2 - е -> О2+) составляет
12,2 эв, а сродство к электрону (О2 + е -> О2-)
-
0,94 эв. Диссоциация молекулярного К. на атомы при обычной темп-ре
ничтожно мала, она становится заметной лишь при 1500 °С; при 5000 °С молекулы
К. почти полностью диссоциированы на атомы.
Физические свойства. К.бесцветный газ, сгущающийся при -182,9 °С и
нормальном давлении в бледно-синюю жидкость, которая при -218,7 °С
затвердевает, образуя синие кристаллы. Плотность газообразного К. (при О °С и
нормальном давлении) 1,42897 г/л. Критическая темп-pa К. довольно
низка (Ткрит = -118,84 °С), т. е. ниже, чем у С12, СО2,
SO2 и некоторых других газов;Ткрит = = 4,97 Мн/м2 (49,71
ат). Теплопроводность (при 0 °С) 23,86- 10-3 вт/(м-К), т.
е. 57-10-6 кал/(сек-см-°С). Молярная теплоёмкость (при
0 °С)
в дж/(моль-К) СР = 28,9 °С = 20,5; в кал/(моль-°С)
С„ = 6,99, С„ = 4,98; СР/С0 = 1,403. Диэлектрич.
проницаемость газообразного К. 1,000547 (0 °С), жидкого 1,491. Вязкость
189 мпуаз (0 °С). К. мало растворим в воде: при 20 °С и 1 ат в
1 м3 воды растворяется 0,031 м3, а при 0 °С
- 0,049 м3 К. Хорошими твёрдыми поглотителями К. являются
платиновая чернь и активный древесный уголь.
Химические свойства. К. образует хим. соединения со всеми элементами, кроме
лёгких инертных газов. Будучи наиболее активным (после фтора) неметаллом,
К. взаимодействует с большинством элементов непосредственно; исключение
составляют тяжёлые инертные газы, галогены, золото и платина; их соединения с
К. получают косвенным путём. Почти все реакции К. с др. веществами - реакции
окисления экзотермичны, т. е. сопровождаются выделением энергии. С водородом
при обычных темп-pax К. реагирует крайне медленно, выше 550 °С эта реакция
идёт со взрывом: 2Н2 + О2 = 2Н2О. С серой,
углеродом, азотом, фосфором К. взаимодействует при обычных условиях очень
медленно. При повышении темп-ры скорость реакции возрастает и при нек-рой,
характерной для каждого элемента темп-ре воспламенения начинается горение.
Реакция азота с К. благодаря особой прочности молекулы N2
эндотермична и становится заметной лишь выше 1200 °С или в электрич. разряде: N2
+ О2 = 2NO. К. активно окисляет почти все металлы, особенно легко -
щелочные и щёлочноземельные. Активность взаимодействия металла с К. зависит от
многих факторов - состояния поверхности металла, степени измельчения,
присутствия примесей (см. Алюминий, Железо, Хром и т. д.).
В процессе взаимодействия вещества с К. исключительно важна роль воды.
Напр., даже такой активный металл, как калий, с совершенно лишённым
влаги К. не реагирует, но воспламеняется в К. при обычной темп-ре в присутствии
даже ничтожных количеств паров воды. Подсчитано, что в результате коррозии ежегодно
теряется до 10% всего производимого металла.
Окиси нек-рых металлов, присоединяя К., образуют перекисные соединения,
содержащие 2 или более связанных между собой атомов К. Так, перекиси Na2O2
и ВаОа включают перекисный ион О22-, надперекиси NaO2
и КО2 - ион О2-, а озониды NaOs, КОз, RbOa и CsO3
- ион О3-. К. экзотермически взаимодействует со многими сложными
веществами. Так, аммиак горит в К. в отсутствии катализаторов, реакция идёт по
уравнению: 4NH3 + ЗО2 = 2N2 4- 6H2O.
Окисление аммиака кислородом в присутствии катализатора даёт NO (этот процесс
используют при получении азотной кислоты). Особое значение имеет горение
углеводородов (природного газа, бензина, керосина) - важнейший источник
тепла в быту и промышленности, например СН4+2О2=
COj + 2H2O. Взаимодействие углеводородов с К. лежит в основе многих
важнейших производств. процессов - такова, напр., т. н. конверсия
метана, проводимая для получения водорода: 2СН4 + О2 + 2Н2О
= 2СО2 + 6Н2 (см. Конверсия газов). Многие
органич. соединения (углеводороды с двойной или тройной связью, альдегиды,
фенолы, а также скипидар, высыхающие масла и др.) энергично присоединяют
К. Окисление К. питательных веществ в клетках служит источником энергии живых
организмов.
Получение. Существует 3 основных способа получения К.: химический,
электролизный (электролиз воды) и физический (разделение воздуха).
Химический способ изобретён ранее других. К. можно получать, напр., из
бертолетовой соли КС1Оз, к-рая при нагревании разлагается, выделяя О2 в
количестве 0,27 м3 на 1 кг соли. Окись бария ВаО при
нагревании до 540 °С сначала поглощает К. из воздуха, образуя перекись ВаО2,
а при последующем нагревании до 870 °С ВаО2 разлагается, выделяя
чистый К. Его можно получать также из KMnO4, Ca2PbO4,
К2Сг2О7 и др. веществ при нагревании и
добавлении катализаторов. Хим. способ получения К. малопроизводителен и
дорог, пром. значения не имеет и используется лишь в лабораторной практике.
Электролизный способ состоит в пропускании постоянного электрич. тока через
воду, в к-рую для повышения её электропроводности добавлен раствор едкого натра
NaOH. При этом вода разлагается на К. и водород. К. собирается около
положительного электрода электролизёра, а водород - около отрицательного. Этим
способом К. добывают как побочный продукт при произ-ве водорода. Для получения
2 м3 водорода и 1 м3 К. затрачивается 12-15 кет-ч
электроэнергии.
Разделение воздуха является основным способом получения К. в современной
технике. Осуществить разделение воздуха в нормальном газообразном состоянии
очень трудно, поэтому воздух прежде сжижают, а уже затем разделяют на составные
части. Такой способ получения К. наз. разделением воздуха методом глубокого
охлаждения. Сначала воздух сжимается компрессором, затем, после прохождения
теплообменников, расширяется в машине-детандере или
дроссельном вентиле, в результате чего охлаждается до темп-ры 93 К (-180°С) и
превращается в жидкий воздух. Дальнейшее разделение жидкого воздуха, состоящего
в основном из жидкого азота и жидкого К., основано на различии темп-ры кипения
его компонентов [Ткип О2 90,18 К (-182,9 °С), t".,,, N2
77,36 К (-195,8 °С)]. При постепенном испарении жидкого воздуха
сначала выпаривается преимущественно азот, а остающаяся жидкость всё более
обогащается К. Повторяя подобный процесс многократно на ректификационных
тарелках воздухоразделительных колонн (см. Ректификация), получают
жидкий К. нужной чистоты (концентрации). В СССР выпускают мелкие (на
неск. л) и самые крупные в мире кислородные воздухоразделительные
установки (на 35 000 м3/ч К.). Эти установки
производят технологический К. с концентрацией 95-98,5%, технический - с
концентрацией 99,2-99,9% и более чистый, медицинский К., выдавая продукцию в
жидком и газообразном виде. Расход электрической энергии составляет от 0,41 до
1,6 квт-nJM3.
К. можно получать также при разделении воздуха по методу избирательного
проницания (диффузии) через перегородки-мембраны. Воздух под повышенным
давлением пропускается через фторопластовые, стеклянные или пластиковые перегородки,
структурная решётка к-рых способна пропускать молекулы одних компонентов и
задерживать другие. Этот способ получения К. пока (1973) используется
лишь в лабораториях.
Газообразный К. хранят и транспортируют в стальных баллонах и ресиверах при
давлении 15 и 42 Ми/м2 (соответственно 150 и 420 бар, или
150 и 420 ат), жидкий К.-в металлич. сосудах Дьюара или в специальных
цистернах-танках. Для транспортировки жидкого и газообразного К. используют
также специальные трубопроводы. Кислородные баллоны окрашены в голубой цсст и
имеют чёрную надпись "кислород".
Применение. Технический К. используют в процессах газопламенной обработки
металлов, в сварке, кислородной резке, поверхностной закалке,
металлизации и др., а также в авиации, на подводных судах и пр. Технологич.
К. применяют в хим. пром-сти при получении искусств, жидкого топлива, смазочных
масел, азотной и серной кислот, метанола, аммиака и аммиачных удобрений,
перекисей металлов и др.хим. продуктов. Жидкий К. применяют при взрывных
работах (см. Оксиликвиты), в реактивных двигателях и в лабораторной
практике в качестве хладагента.
Заключённый в баллоны чистый К. используют для дыхания на больших высотах,
при космич. полётах, при подводном плавании и др. В медицине К. дают для
вдыхания тяжело больным, применяют для приготовления кислородных, водяных и
воздушных (в кислородных палатках) ванн, для внутримышечного введения и
т. п. (см. Кислородная терапия).
В. Л. Василевский, И. П. Вишнев, А. И.
Перельман.
К. в металлургии широко применяется для интенсификации ряда пирометаллургич.
процессов. Полная или частичная замена поступающего в металлургич. агрегаты
воздуха кислородом изменила химизм процессов, их теплотехнич. параметры и
технико-экономич. показатели. Кислородное дутьё позволило сократить потери тепла
с уходящими газами, значит, часть к-рых при воздушном дутье составлял азот. Не
принимая существ, участия в хим. процессах, азот замедлял течение реакций,
уменьшая концентрацию активных реагентов окислительно-восстановительной среды.
При продувке К. снижается расход топлива, улучшается качество металла, в
металлургич. агрегатах возможно получение новых видов продукции (напр., шлаков
и газов необычного для данного процесса состава, находящих спец. технич.
применение) и др.
Первые опыты по применению дутья, обогащённого К., в доменном производстве
для выплавки передельного чугуна и ферромарганца были проведены одновременно в
СССР и Германии в 1932-33. Повышенное содержание К. в доменном дутье
сопровождается большим сокращением расхода последнего, при этом увеличивается
содержание в доменном газе окиси углерода и повышается его теплота сгорания.
Обогащение дутья К. позволяет повысить производительность доменной печи, а в
сочетании с газообразным и жидким топливом, подаваемым в горн, приводит к
снижению расхода кокса. В этом случае на каждый дополнит, процент К. в дутье
производительность увеличивается примерно на 2,5%, а расход кокса снижается на
1 %.
К. в мартеновском производстве в СССР сначала использовали для
интенсификации сжигания топлива (в пром. масштабе К. для этой цели впервые
применили на з-дах "Серп и молот" и "Красное
Сормово" в 1932-33). В 1933 начали вдувать К. непосредственно в
жидкую ванну с целью окисления примесей в период доводки. С повышением
интенсивности продувки расплава на 1 м3/т за 1 ч производительность
печи возрастает на 5-10%, расход топлива сокращается на 4-5%. Однако при
продувке увеличиваются потери металла. При расходе К. до 10 м3/т за
1 ч выход стали снижается незначительно (до 1 %). В мартеновском
произ-ве К. находит всё большее распространение. Так, если в 1965 с применением
К. в мартеновских печах было выплавлено 52,1% стали, то в 1970 уже 71%.
Опыты по применению К. в электросталеплавильных печах в СССР были начаты в
1946 на з-де "Электросталь". Внедрение кислородного дутья позволило
увеличить производительность печей на 25-30%, снизить удельный расход
электроэнергии на 20-30%, повысить качество стали, сократить расход электродов
и нек-рых дефицитных легирующих добавок. Особенно эффективной оказалась подача
К. в электропечи при произ-ве нержавеющих сталей с низким содержанием углерода,
выплавка к-рых сильно затрудняется вследствие науглероживающего действия
электродов. Доля электростали, получаемой в СССР с использованием К., непрерывно
растёт и в 1970 составила 74,6% от общего произ-ва стали.
В ваграночной плавке обогащённое К. дутьё применяется гл. обр. для высокого
перегрева чугуна, что необходимо при произ-ве высококачественного, в частности
высоколегиров., литья (кремнистого, хромистого и т. д.). В зависимости
от степени обогащения К. ваграночного дутья на 30-50% снижается расход топлива,
на 30-40% уменьшается содержание серы в металле, на 80-100% увеличивается
производительность вагранки и существенно (до 1500 °С) повышается
темп-pa выпускаемого из неё чугуна.
О значении К. в конвертерном произ-ве см. в ст. Кислородно-конвертерный
процесс.
К. в цветной металлургии получил распространение несколько позже, чем в
чёрной. Обогащённое К. дутьё используется при конвертировании штейнов, в
процессах шлаковозгонки, вельцевания, агломерации и при отражательной
плавке медных концентратов. В свинцовом, медном и никелевом произ-ве
кислородное дутьё интенсифицировало процессы шахтной плавки, позволило снизить
расход кокса на 10-20%, увеличить проплав на 15-20% и сократить кол-во флюсов в
отд. случаях в 2-3 раза. Обогащение К. возд. дутья до 30% при обжиге цинковых
сульфидных концентратов увеличило производительность процесса на 70% и
уменьшило объём отходящих газов на 30%. Разрабатываются новые высокоэффективные
процессы плавки сульфидных материалов с применением чистого К.: плавка в
кислородном факеле, конвертирование штейнов в вертик. конвертерах, плавка в
жидкой ванне и др.
Лит.: Чугаев Л. А., Открытие
кислорода и теория горения в связи с философскими учениями древнего мира, Избр.
труды, т. 3, М., 1962, с. 350; Коттон Ф., Уилкинсон Дж., Современная
неорганическая химия, пер. с англ., т. 1 - 3, М., 1969; Некрасов Б. В., Основы
общей химии, т. 1, М., 1965; Кислород. Справочник, под ред. Д. Л. Глизманенко,
ч. 1 - 2, М., 1967; Разделение воздуха методом глубокого охлаждения, под ред.
В. И. Епифановой, Л. С. Аксельрода, т. 1-2, М., 1964; Справочник по
физико-техническим основам глубокого охлаждения, М.- Л., 1963.
С. Г. Афанасьев.
КИСЛОРОДНАЯ ЁМКОСТЬ КРОВИ, количество кислорода, к-рое может быть
связано кровью при её полном насыщении; выражается в объёмных процентах (об% );
зависит от концентрации в крови гемоглобина. Определение К. ё. к. важно
для характеристики дыхательной функции крови. К. ё. к. человека - ок.
18-20 об%.
КИСЛОРОДНАЯ ЗАДОЛЖЕННОСТЬ, дополнительное количество кислорода,
потребляемое организмом после физич. работы на окисление накопившихся
недоокисленных продуктов обмена веществ. К. з. свидетельствует об отставании
потребления кислорода во время работы от потребности в нём организма.
Определение К. з., производимое путём исследования газообмена, важно при
решении нек-рых вопросов физиологии труда и спорта, оценке состояния
сердечно-сосудистой и дыхательной систем. Термином "К. з." иногда
обозначают расхождение между потребностью организма в кислороде и его фактич.
потреблением при различных обстоятельствах, связанных с кислородным голоданием,
или гипоксией.
КИСЛОРОДНАЯ РЕЗКА, газовая резка, способ резки металлич. деталей,
осн. на свойстве металлов, нагретых до темп-ры воспламенения, гореть в
технически чистом кислороде. При К. р. на нагретый до 1200-1300 °С
металл направляют струю кислорода, прожигающую металл и разрезающую его.
Образующиеся окислы железа в расплавленном состоянии вытекают и выдуваются из
полости реза. Этим способом режут изделия из углеродистых низко- и
среднелегированных сталей обычно толщиной от 1 мм до 200-300 мм (возможна
К. р. стали толщиной до 2 м).
К. р. производят резаком - спец. сварочной горелкой с дополнит,
устройством для подвода кислорода. В зависимости от использования для нагрева
еталла горючего газа различают ацетилено-кислородную, водородно-кислородную,
бензино-кислородную и др. резку, ручную и машинную. Машинная К. р.
обеспечивает высокую точность и чистоту реза при большой производительности. На
машинах (рис.) производят резку по шаблонам, специальным направляющим,
чертежу, копируя его в любом масштабе; возможно использование сразу неск.
резаков для одновременной резки деталей. К. р. можно автоматизировать,
используя фотоэлектронное устройство.
Разновидностью К. р. является флюсо-кислородная резка, к-рой разделяют
металлы, трудно поддающиеся резке (высокохромистые и хромоникелевые стали),
а также чугуны и алюминиевые сплавы. В этом случае процесс облегчают вдуваемые
вместе с кислородом порошкообразные флюсы. Кроме разделительной К. р.,
при к-рой режущая струя почти перпендикулярна поверхности металла, применяют
кислородную обработку (т. н. строжку). При этом режущую струю направляют
под небольшим углом (почти параллельно) к поверхности металла.
К. р. широко распространена в машиностроении, судостроении, в чёрной и
цветной металлургии, в строительстве и др. отраслях. Наряду с К. р. в пром-сти
получила распространение плазменная резка (см. Плазменная обработка).
Лит.: Хренов К. К., Сварка, резка и пайка металлов, 4 изд., М., 1973.
К. К. Хренов.
КИСЛОРОДНАЯ ТЕРАПИЯ, оксигенотерапия (от лат. Oxygenium - кислород и терапия),
искусственное введение кислорода в организм человека с яеч. целью. К. т.
применяют обычно для лечения заболеваний, сопровождающихся гипоксемией (болезни
сердечно-сосудистой системы; пневмонии, эмфизема лёгких; высотная болезнь;
отравление удушающими газами - хлором, фосгеном и др.), а также при
лечении нек-рых гнойно-гнилостных процессов мягких тканей (напр., гангрена) и
др. Для К. т. применяют как чистый кислород, так и смесь его с воздухом или с
двуокисью углерода (5-7%), т. н. карбоген. Кислород вводят в организм
ингаляционным путём, подкожно, внутрибрюшинно, через кишечник (для изгнания
глистов) и т. д. Для К. т. используют катетеры, маски, кислородные
подушки, спец. ингаляторы, кислородные палатки и тенты. Применяют также лечение
кислородом под повышенным давлением - гипербарическую оксигенацию.
КИСЛОРОДНО-ДЫХАТЕЛЬНАЯ АППАРАТУРА, приборы для проведения кислородной
терапии. Простейшим из них является кислородная подушка - прорезиненный
мешок (ёмкость 12-16 л), наполненный кислородом и снабжённый резиновой
трубкой с краном и мундштуком. Применяют носовые катетеры или пластмассовые трубки,
к-рые надевают на два ответвления тройника, третий конец к-рого подсоединён к
любому источнику кислорода. Катетеры вводят по нижнему носовому ходу, кислород
через увлажнитель подают со скоростью 2-3 л/мин. Дыхат. маски
представляют собой металлич. или пластмассовые капсулы, изогнутые так, чтобы
при наложении на лицо покрывать ротовое отверстие и нос. Маски имеют
вдыхательные и выдыхательные клапаны, позволяющие регулировать скорость подачи
кислорода.
Рис. 1. Кислородный ингалятор: 1 - баллон с кислородом; 2 - редуктор
с манометрами; 3 - инжектор; 4 - дыхательный мешок; 5 -
предохранительный клапан; 6маска; 7 - выдыхательный клапан.
Рис. 2. Кислородная палатка (вид сбоку): 1 - тент; 2 - петли; 3 - штанга;
4 и 5 - консоли для установки тента; 6 - газоанализатор для
контроля содержания О2 и СО2 в подпалаточном
пространстве; 7 - вентиляционная труба; 8 - гайки крепления; 9 - окна
из плексигласа; 10 - редуктор; 11 - резервуар с мотором, вентилятором,
сосудом с поглотителем углекислоты и для льда; 12 - приёмник воды,
образующейся при таянии льда.
Катетеры или маски являются неотъемлемой частью кислородных ингаляторов,
состоящих из металлич. баллона (или неск. соединённых между собой баллонов),
в к-ром находится кислород под давлением 150 атм, и редуктора, снабжённого
двумя манометрами (рис. 1). Переносные кислородные ингаляторы имеют
ёмкость от 0,7 до 1,5 л. Баллонами большой ёмкости снабжают ингаляторы,
предназначенные для горноспасательных станций, пожарных автомобилей и т. д., а
также для стационарных установок в больницах. При палаточном методе кислородной
терапии палатка или тент из непропускающего газ материала подвешивается на
спец. держателе над изголовьем постели. Тент снабжён окнами из
плексигласа; держатель тента, баллоны с кислородом и редуктор размещают на
металлич. площадке (рис. 2). Кислород поступает в подпалаточное
пространство со скоростью 6-8 л/'мин. Воздушная смесь этого пространства
насосом непрерывно прогоняется через регенератор, в к-ром содержится
поглотитель углекислоты и резервуар со льдом для охлаждения воздуха и удаления
излишней влаги. Концентрация кислорода в подпалаточном пространстве держится на
уровне 60-80%, темп-pa и влажность соответствуют зоне комфорта.
КИСЛОРОДНОЕ ГОЛОДАНИЕ, кислородная недостаточность, состояние
организма, характеризующееся тем, что поступление О2 к тканям и
органам или их способность утилизировать О2 ниже потребностей
животного или человека в кислороде; то же, что гипоксия.
КИСЛОРОДНО-КОНВЕРТЕРНАЯ СТАЛЬ, сталь, выплавляемая в кислородных
конвертерах; см. Сталь.
КИСЛОРОДНО-КОНВЕРТЕРНЫЙ ПРОЦЕСС, один из видов передела жидкого
чугуна в сталь без затраты топлива путём продувки чугуна в конвертере
технически чистым кислородом сверху. О целесообразности использования кислорода
при произ-ве стали в конвертерах указывал ещё в 1876 русский металлург Д. К. Чернов.
Впервые применил чистый кислород для продувки жидкого чугуна снизу сов.
инженер Н. И. Мозговой в 1936. В 1939-41 на Московском заводе станкоконструкций
извлекают из конвертера. Продувка обычно длится 15-22 мин. Полученный
металл содержит в растворе избыток кислорода, поэтому заключит, стадия плавки -
раскисление металла. Течение К.-к. п. (т. е. последовательность реакций
окисления примесей чугуна) обусловливается температурным режимом
процесса и регулируется изменением кол-ва дутья или введением в конвертер
"охладителей" (скрапа, железной руды, известняка).
Темп-pa металла при выпуске ок. 1600 °С. На рис. приведена схема получения
стали в кислородном конвертере. К.-к. п. осуществляется в конвертере с основной
смолодоломитовой (доломит, смешанный со смолой) футеровкой и с глухим
дном; кислород под давлением более 1 Л-Сн/м2 (10 кгс/см2)
подаётся водоохлаждаемой фурмой через горловину конвертера. С целью
образования осн. шлака, связывающего фосфор, в конвертер в начале продувки
добавляют известь. Под воздействием дутья примеси чугуна (кремний, марганец,
углерод и др.) окисляются, выделяя значит, количество тепла, в
результате чего одновременно снижается содержание примесей в металле и повышается
темп-pa, поддерживающая его в жидком состоянии. Когда содержание углерода
достигает требуемого значения (кол-во углерода определяется по времени от
начала продувки и по кол-ву израсходованного кислорода), продувку
прекращают.
Схема получения стали в кислородном конвертере; а - загрузка
металлолома; 6-заливка чугуна; в - продувка; г - выпуск
стали; д - слив шлака.
Проводились опыты по продувке чугуна сверху кислородом в 1,5-т ковше и
выплавлялась сталь для фасонного литья. Впервые К.-к. п. был опробован в пром.
масштабе в Австрии в 1952. Первый кислородно-конвертерный цех в СССР был введён
в эксплуатацию в Днепропетровске на металлургич. з-де им. Петровского в
1956. Применение при конвертировании кислородного дутья вместо воздушного (см.
Бессемеровский процесс, Томасовский процесс) позволило получать сталь с низким содержанием
азота (0,0020,006%). При К.-к. п. значительно увеличивается кол-во
тепла, получаемого ванной на единицу окисляющегося элемента, т. к. отсутствует
расход тепла на нагрев азота, вводимого в ванну при продувке воздухом. В связи
с этим появляется возможность переработки чугунов с низким содержанием кремния
и фосфора, а также переплава больших кол-в скрапа (до 25% ) или руды (до
5% ). Обработка чугуна струёй кислорода, подаваемой на поверхность
ванны, имеет ряд преимуществ по сравнению с продувкой через днище.
Высокотемпературный кислородный факел, направляемый на поверхность ванны,
интенсивно прогревает шлак, поэтому возможно раннее наведение активного шлака и
регулирование содержания окислов железа в нём, что улучшает условия
дефосфорации металла. Удаление фосфора возможно при высоком содержании углерода
в ванне. При томасовском же процессе дефосфорация происходит только в конце
плавки - при низком содержании углерода (0,04-0,06% ). Высокая темп-ра
К.-к. п. способствует интенсивному окислению углерода, поэтому содержание
кислорода, растворённого в металле, снижается до 0,005-0,01%. Расход кислорода
на 1 т чугуна при К.-к. п. составляет 53 м3. При
одном и том же качестве стали К.-к. п. по сравнению с мартеновским (см. Мартеновское
производство) даёт экономию по капиталовложениям на 20-25%, снижение
себестоимости стали на 2-4% и увеличение производительности труда на 25-30%. В
СССР за 1965-71 выплавка стали в кислородных конвертерах увеличена с 4 до 23,2
млн. т в год, или в 5,8 раза. Рост производства конвертерной
стали сопровождается ростом ёмкости конвертеров. С технологической точки
зрения, увеличение ёмкости конвертера не создаёт к.-л. дополнит, трудностей
ведения плавки. Поэтому даже в крупных конвертерах выплавляют не только рядовую
низкоуглеродистую сталь, но и среднеуглеродистую, высокоуглеродистую,
низколегированную и легированную стали.
Лит.: Применение кислорода в конвертерном производстве стали, М.,
1959; Туркенич Д. И., Автоматизация процесса плавки в кислородном конвертере,
[М.], 1966; Бережинский А. И., Xомутинников П. С., Утилизация, охлаждение и
очистка конвертерных газов, М., 1967; Явойский В. И., Теория процессов
производства стали, 2 изд., М., 1967; Конвертерные процессы производства стали,
М., 1970.
С. Г. Афанасьев.
КИСЛОРОДНЫЙ КОНВЕРТЕР, см. Конвертер.
КИСЛОРОДНЫЙ ЭФФЕКТ в радиобиологии, защитное действие пониженного
содержания кислорода (гипоксии) при облучении живых организмов
ионизирующей радиацией. К. э. проявляется у всех биол. объектов
(микроорганизмы, растения, животные) и на всех уровнях их организации
(субклеточном, клеточном, тканевом, органном и организменном),
значительно ослабляя все радиобиол. реакции (биохим. нарушения, мутации, угнетение
роста и развития) и повышая выживаемость облучён| ных организмов.
Механизм защитного действия гипоксии объясняется тем, что при облучении в
присутствии кислорода образуются перекисные радикалы, усиливающие действие
излучений на жизненно важные макромолекулы и структуры клеток и (или) ослабляющие
эффективность внутриклеточных защитных веществ. Величина К. э. зависит гл. обр.
от вида радиации и условий облучения. Наибольший К. э. наблюдается при действии
рентгеновских лучей и гамма-лучей; с ростом плотности ионизации К. э.
уменьшается, а при действии наиболее плотно ионизирующих излучений
(напр., альфа-лучей) практически отсутствует. В нормально
обводнённых активно жизнедеятельных биол. объектах ослабление лучевого
поражения имеет место только при применении гипоксии во время облучения, в
сухих объектах (покоящиеся семена растений, споры бактерий) - и при
гипоксии после облучения, во время перехода облучённых объектов к активной
жизнедеятельности (напр., при проращивании семян). К. э. находит
применение в лучевой терапии: повышая содержание кислорода в опухоли и
создавая гипоксические условия в окружающих тканях, можно усиливать лучевое
поражение опухолевых клеток, одновременно уменьшая повреждение здоровых тканей.
Лит.: Кислородный эффект при действии ионизирующих излучений, М.,
1959; Бак З., Александер П., Основы радиобиологии, пер. с англ., М., 1963.
В.
И. Иванов.
КИСЛОТНОСТЬ ПОЧВЫ, одно из важнейших свойств многих почв,
обусловленное наличием водородных ионов в почвенном растворе, а также обменных
ионов водорода и алюминия в почв, поглощающем комплексе. Повышенная К. п.
отрицательно влияет на развитие растений и мн. полезных почв, микроорганизмов.
Различают 2 формы К. п.: актуальную, или активную,- кислотность почв, раствора,
почв, суспензии или водной вытяжки из почв, и потенциальную, или пассивную,
"скрытую", - кислотность твёрдой фазы почвы. Актуальная К. п.
обусловлена наличием ионов водорода. Выражается условной величиной рН
(отрицательный логарифм концентрации водородных ионов); при рН 7 реакция
почв, раствора нейтральная, ниже 7 - кислая; чем ниже числовое значение рН, тем
выше К. п. Потенциальную К. п. делят на обменную и гидролитическую. Обменная К.
п. вызывает значит, подкисление почв, раствора при взаимодействии почвы с
нейтральной солью, что наблюдается при внесении в почву физиологически кислых
удобрений (хлористый калий, сернокислый аммоний и др.). По
представлениям рус. учёного К. К. Гедройца и нек-рых др. исследователей,
обменная К. п. обусловлена присутствием в твёрдой фазе почвы ионов водорода,
способных к обмену на катионы нейтральных солей и переходу в почв, раствор.
Согласно суждениям др. учёных, обменная К. п. может быть объяснена присутствием
в поглощённом состоянии как ионов водорода, так и ионов алюминия в разных
соотношениях. Гидролитическая К. п. обусловливается присутствием в почве ионов
водорода, не вытесняемых нейтральными солями из поглощающего комплекса, но
способных к замещению (обмену) на др. катионы при обработке почвы
растворами щелочей или гидролитически щелочных солей (напр., раствором ацетата
натрия, к-рый и применяется при определении гидролитич. кислотности).
Степень К. п. необходимо учитывать при выборе минеральных удобрений, подготовке
их перед внесением в почву. Основной способ борьбы с повышенной К. п.- известкование
почв.
Д. Л. Аскинази.
КИСЛОТНО-ЩЕЛОЧНОЕ РАВНОВЕСИЕ, кислотно-щелочной баланс,
кислотно-щелочное состояние, совокупность физико-хим. и физиол. процессов,
обусловливающих относительное постоянство водородного показателя (рН)
внутр. среды организма. В норме рН крови человека поддерживается в пределах
7,35-7,47, несмотря на поступление в кровь кислых и основных продуктов обмена
веществ. Постоянство рН внутр. среды организма - необходимое условие
нормального течения жизненных процессов (см. Гомеостаз). Значения рН
крови, выходящие за указанные пределы, свидетельствуют о существенных
нарушениях в организме, а значения ниже 6,8 и выше 7,8 несовместимы с жизнью. В
регуляции постоянства рН крови принимают участие буферные системы крови
[состоят из слабых к-т и их солей, образованных сильными основаниями, напр. гемоглобин,
обладающий свойствами слабой к-ты, и его калиевая соль; угольная к-та
(НгСОз) и бикарбонат натрия (NaHCO3) и др.] и мн.
физиол. системы организма. Механизм сохранения К.-щ. р. буферными системами можно
пояснить на примере действия бикарбонатного буфера. Если в кровь поступает
сильная к-та, напр, соляная, то она реагирует с бикарбонатом; при этом
образуется слабая угольная к-та, почти не меняющая рН среды (NaHCO3
+ НС1 = NaCl + Н2СО3). При поступлении в кровь
сильного основания оно, реагируя с угольной кислотой, образует
бикарбонат, не изменяющий заметно рН крови. По мере накопления угольный кислоты
или бикарбонатов ёмкость бикарбонатного буфера должна была бы быстро
истощиться, но этого не происходит вследствие действия физиологических систем
(напр., дыхательной системы, выделительной и др.), восстанавливающих
ёмкость бикарбонатного буфера. Так, при накоплении угольной к-ты последняя
удаляется через лёгкие, избыток же бикарбоната выводится через почки. Сдвиг рН
крови в кислую сторону наз. аццдозо.м, в щелочную - алкалозом. рН большинства
тканевых жидкостей организма поддерживается на уровне 7,1-7,4.
Лит.: Робинсон Дж. Р., Основы регуляции кислотно-щелочного
равновесия, пер. с англ., М., 1969.
В. П. Мишин.
КИСЛОТНЫЕ КРАСИТЕЛИ, растворимые в воде красители анионного
характера; преимущественно это антрахиноновые красители и азокрасители.
Широко применяются для окраски шерсти, натурального шёлка и полиамидного
волокна, а также кожи, меха, бумаги, древесины и других материалов.
Целлюлозными волокнами не адсорбируются. См. также Крашение.
Лит.: Андросов В. Ф., Голомб Л. М., Синтетические красители в
текстильной промышленности, М., 1968.
КИСЛОТОУПОРНОСТЬ, кислотостойкость, способность материалов
противостоять разрушающему действию кислот. К. зависит от природы материала,
окислительно-восстановительных свойств среды, природы анионов, концентрации и
темп-ры кислот. Напр., хром и хромистые стали устойчивы в 40%-ной азотной к-те
и интенсивно разрушаются в 40%-ной серной. С повышением темп-ры К. материалов
снижается. Следует различать К. в жидкой и парогазовой фазах и на их границе.
К. металлич. материалов определяется по потерям массы с единицы поверхности (г/м2
в ч). К. неметаллич. органич. материалов оценивается по степени
набухаемости и изменению механич. свойств (предела прочности, предела
текучести, удлинения при разрыве и др.). К. неметаллич. неорганич.
материалов определяется по изменению массы измельчённого материала после
обработки кислотой. См. также Кислотоупорные материалы, Коррозионностойкие
материалы.
В. П. Батраков.
КИСЛОТОУПОРНЫЕ МАТЕРИАЛЫ, кислотостойкие матер и ал ы, металлические
и неметаллич. материалы, стойкие против разрушающего действия кислот. Среди
металлич. К. м. наиболее широкое применение находят деформированные и литейные
высоколегиров. стали, сплавы на основе Ni, Cu и
Al, чистые металлы: Ni, Al,
Cu
и Pb. Перспективно применение Ti и сплавов на его основе. Для особо
ответственных конструкций используют Zr, Та, Nb и их сплавы. При выборе металлич.
К. м. учитывают окислительно-восстановит. свойства среды
(окислительно-восстановит. потенциал), а также природу анионов,
концентрацию и темп-ру кислот. В окислит. средах успешно применяются материалы,
на поверхности к-рых при воздействии агрессивной среды образуется плёнка хим.
соединения с высокими защитными свойствами (нержавеющие стали, нихромы,
Al и
сплавы на его основе, Ti, высокохромистые и высококремнистые чугуны). В
сильноокислит. средах возникает перепассивация мн. нержавеющих сталей и никелевых
сплавов. В восстановит, средах применяют металлич. материалы, имеющие высокую
термодинамич. устойчивость: Cu; Ni; никелевые сплавы,
содержащие Мо (гастелой) или Cu (монелъ-металлы); титановые сплавы, легиров. Мо. В
слабоокислит. и слабовосстановит. средах применяют сложные по хим. составу
стали и сплавы, легиров. металлами, повышающими их пассивируемость и
термодинамич. устойчивость: высоколегированные Ni, Mo и Cu нержавеющие стали,
никелевые сплавы с добавками Сг, Мо и W, Ti с небольшим количеством Pd и др.
Неметаллич. К. м. подразделяют на органические и неорганические. Среди
органич. К. м. всё возрастающее применение находят полимерные материалы:
фаолит, поливинилхлорид, полиэтилен, полипропилен, поликарбонат,
фторопласты и др. Фторопласты отличаются наибольшей хим. стойкостью, они не
разрушаются даже в сильноокислит. средах. Из указанных материалов
изготавливаются листы, трубы, прутки, фасонные изделия. Мн. из них хорошо
свариваются, склеиваются, армируются стеклянным волокном. В качестве
теплопроводящего К. м. применяют графит, в т. ч. пропитанный различными
смолами. К неорганич. К. м. относятся: кислотоупорная керамика, каменное литьё,
силикатные и кварцевые стёкла, ситаллы, асбест, фарфор, кислотоупорные
эмали, замазки, бетон и цемент. См. также Коррозионностойкие материалы.
Лит.: Батраков В. П., Коррозия конструкционных материалов в
агрессивных средах, М., 1952; Пластмассы и синтетические смолы в
противокоррозионной технике, М., 1964; Клинов И. Я., Коррозия химической
аппаратуры и коррозионностойкие материалы, 4 изд., М., 1967.
В. П. Батраков.
КИСЛОТОУСТОЙЧИВЫЕ БАКТЕРИИ, виды бактерий, клетки к-рых после их
окрашивания карболовым фуксином в красный цвет не обесцвечиваются раствором серной
к-ты. Это связано с особенностями химич. состава бактериальных клеток.
Оптимальная реакция питательной среды для роста К. б. не кислая, а нейтральная.
К ним относятся нек-рые виды микобактерий, в т. ч. болезнетворные,
вызывающие проказу, туберкулёз (как животных, так и человека), а также
встречающиеся в почве бактерии, фиксирующие молекулярный азот.
КИСЛОТЫ, хим. соединения, содержащие водород, способный замещаться
металлом с образованием солей, и диссоциирующие при растворении в воде с
образованием ионов Н+ (протонов) или, точнее, ионов
гидроксония НзО+. По современным представлениям, к К. относятся
также нек-рые соединения, не содержащие водорода (подробнее см. Кислоты и
основания).
КИСЛОТЫ И ОСНОВАНИЯ, классы хим. соединений. Обычно кислотами наз. вещества,
содержащие водород (НС1, HNO3, H2SO4, СН3СООН
и т. д.) и диссоциирующие в воде с образованием ионов Н+
(точнее, ионов гидроксония Н3О+). Присутствие этих ионов
обусловливает характерный острый вкус водных растворов кислот, а также их
способность изменять окраску индикаторов химических. По числу
отщепляющихся протонов различают кислоты одноосновные (напр., азотная НЫОз,
соляная НС1, уксусная СНзСООН), двухосновные (серная H2SO4,
угольная Н2СОз), трёхосновные (ортофосфорная Н3РО4).
Чем больше ионов гидроксония присутствует в водном растворе кислоты, т. е. чем
выше степень диссоциации последней, тем кислота сильнее. Кислоты, полностью
диссоциированные в разбавленных растворах, наз. сильными. К слабым относятся кислоты с
константой ионизации (характеризующей степень диссоциации кислоты в растворе,
напр., при 25 °С) ниже 10-5 (уксусная 1.8-10-5,
синильная 7,9-10-10). Диссоциация многоосновных кислот
происходит в неск. ступеней, каждая из к-рых имеет свою константу ионизации.
Напр., константа ионизации Н3РО4 на Н+ и Н2РО4-
7-10-3, Н2РО4- на Н+ и НРО42-
8-10-8, НРО42- на Н+ и РО43-4,8-10-13.
Об органич. к-тах см. также Карболовые кислоты. Основаниями обычно наз.
вещества, содержащие гидроксильную группу ОН [КОН, NaOH, Са(ОН)2
и др.] и способные диссоциировать в водном растворе с образованием
гидроксильных ионов ОН-. Большинство оснований нерастворимо в воде. Растворимые
в воде основания наз. щелочами. Присутствием ионов ОН- и объясняется
характерный щелочной вкус растворов щелочей, а также их способность изменять
окраску индикаторов. Основания с 1, 2, 3 гидроксильными группами наз.
соответственно одно-, двух-, трёхкислотными. Не полностью диссоциирующие при
растворении в воде основания наз., как и кислоты, слабыми. К сильным основаниям
относятся гидроокиси калия КОН, натрия NaOH, бария Ва(ОН)2. О принципах
установления названий К. и о. см. Номенклатура неорганических соединений. Понятия
К. и о. возникли ещё на заре развития химии. В 1778 франц. химик А. Л. Лавуазье
попытался объяснить особенности свойств кислот содержанием кислорода.
Несостоятельность такого мнения стала очевидной, когда оказалось, что мн.
кислородсодержащие вещества (окислы металлов, щёлочи, соли и др.) не
проявляют кислотных свойств, а ряд типичных кислот (соляная, синильная,
плавиковая и др.), как показали англ, учёный Г. Дэви (1810) и
франц. учёный Ж. Л. Гей-Люссак (1814), не содержат кислорода. Швед, химик И. Я.
Берцелиус (1812-19) видел причину кислотных и основных свойств в
электрич. природе окислов: электроотрицательные окислы неметаллов (и нек-рых
металлов-хрома, марганца) он считал кислотами, а электроположительные
окислы металлов - основаниями. В 1814 Г. Дэви предложил признать носителем
кислотных свойств водород, входящий в состав всех известных тогда соединений,
обладающих кислотными свойствами, а нем. химик Ю. Либих (1833) внёс
существенное уточнение, что кислотные свойства вещества обусловлены не всеми
содержащимися в нём атомами водорода, а лишь теми из них, к-рые могут
замещаться металлом с образованием солей. После появления (1884-87) теории
электролитической диссоциации швед, учёного С. Аррениуса кислотами стали
наз. соединения, при диссоциации к-рых в водном растворе образуются ионы
водорода Н+, а основаниями - соединения, диссоциирующие с отщеплением
иона гидроксила ОН-. По мере развития теории растворов стало ясно, что
важную роль в процессе электролитич. диссоциации веществ играет взаимодействие
как самих веществ, так и продуктов их диссоциации с растворителем. Было
выяснено также, что ион Н+ не может находиться в растворе в
свободном виде: вследствие очень высокой плотности заряда он прочно соединяется
с молекулами растворителя (сольватируется) и реально существует в виде
сольватного иона, в водных растворах - иона гидроксония, к-рый и является носителем
кислотных свойств.
Определение понятий К. и о. на основе теории электролитич. диссоциации часто
вполне достаточно для практич. целей. Однако, как было установлено уже давно,
мн. соединения, проявляющие типичные свойства К. и о., не содержат ни водорода,
ни групп ОН. Кроме того, одно и то же вещество нередко в одних реакциях ведёт
себя как кислота, а в других - как основание (см. Амфотерность). Способность
вещества реагировать как кислота или основание является, т. о., не абсолютным
свойством этого вещества, а выражается в конкретных хим. реакциях, относимых к
классу кислотноосновных. В таких реакциях одно из взаимодействующих веществ
играет роль кислоты по отношению к др. веществу, играющему роль основания.
Итак, способность вещества реагировать в качестве кислоты или основания
является его функциональной характеристикой. Было предпринято множество попыток
разработать единую теорию, к-рая позволила бы, с учётом указанных
обстоятельств, однозначно относить данное вещество к классу кислот или оснований.
Однако до сих пор единого критерия для этого не найдено. Наиболее
распространены две концепции - дат. физико-химика И. Н. Брёнстеда и амер.
физикохимика Г. Н. Льюиса (1923). Брёнстед относит к классу кислот
водородсодержащие вещества, отдающие при реакциях положительные ионы водорода -
протоны (т. н. протонные, или брёнстедовские, кислоты), а к классу
оснований - вещества, присоединяющие протоны. Функции К. и о., по Брёнстеду,
могут выполнять как нейтральные молекулы, так и ионы. Хим. реакция, при к-рой происходит
передача протона от кислоты к основанию: АН + В- -> А- + ВН (где АН -
кислота, а В- - основание), наз. кислотно-основной, или протолитической.
Поскольку протолитич. реакции обратимы, причём в обратной реакции, так же как и
в прямой, происходит передача протона, продукты прямой реакции также выполняют
друг по отношению к другу функции К. и о. (т. н. сопряжённые К. и о.),
т. е. ВН - кислота, а А - основание. Напр., в реакции: H2SO4
+ Н2О -> HSO-4 + H3O+
кислотами являются H2SO4 и Н3О+, a
HSO4 - и Н2О - основания. Концепция Брёнстеда
даёт чёткий критерий для отнесения хим. реакций к типу кислотно-основных,
позволяет выражать в количеств, форме основные характеристики протолитич.
равновесий и расположить водородсодержащие вещества в ряд по возрастанию их
способности отдавать протон, т. е. по их кислотности. Эти достоинства теории
протолитич. равновесий обусловили её предсказательную силу и обеспечили широкое
использование брёнстедовских представлений в хим. практике. В то же время
концепции Брёнстеда свойственна ограниченность, выражающаяся в том, что,
связывая кислотные свойства вещества с наличием в его составе водорода, она всё
же оставляет в стороне большое число веществ кислотного характера, не
содержащих водорода. К таким веществам, получившим в химии назв. а протонных,
или льюисовских, кислот, относятся электронно-ненасыщенные соединения,
напр, галогениды бора, алюминия и олова, окислы нек-рых металлов и т. д.
Согласно концепции Льюиса, восполняющей в какой-то степени вышеуказанный
пробел, кислотой наз. вещество, присоединяющее при хим. реакции пару
электронов, а основанием - вещество, отдающее пару электронов. Результатом
является восполнение электронной ненасыщенности молекулы кислоты за счёт
электронов основания, а также возникновение нового соединения (соли) с
устойчивой электронной оболочкой (в частности, октетом) и
донорно-акцепторной связью, напр.:
где ВРз - кислота, a NH3 - основание. Важная особенность
кислотно-основных реакций, по Льюису, состоит в обобществлении электронной пары
основания. Этим они отличаются от окислительно-восстановительных реакций, в
ходе к-рых молекулы окислителя полностью отбирают по одному или неск.
электронов у молекул восстановителя; никаких обобществлённых орбит при этом не
возникает. В отличие от Брёнстеда, Льюис связывает кислотно-основные свойства
не с наличием определённых хим. элементов (в частности, водорода), а
исключительно со строением внешних электронных оболочек атомов. В то же время
между обеими концепциями имеется внутр. связь, основанная на том, что для иона
Н+, так же как и для льюисовских кислот, характерно сильное сродство
к электронной паре. Кроме двух рассмотренных концепций К. и о., известны
нек-рые другие, к-рые не получили, однако, столь широкого распространения.
Как брёнстедовские, так и льюисовские теории К. и о. широко применяются на
практике. Изменение кислотности или основности среды часто используют с целью
увеличения скорости реакций и изменения механизма взаимодействия. В этом
состоит сущность кислотно-основного катализа, широко используемого в
хим. пром-сти; при этом важно, что брёнстедовские и лыоисовские кислоты
оказывают во многих случаях сходное каталитич. действие. Широкое применение
получили кислотно-основные процессы в хим. пром-сти (нейтрализация, гидролиз,
травление металлов и т. д.). Мн. кислоты (серная, азотная,
соляная, ортофосфорная и др.) и щёлочи (едкое кали, едкий натр и др.) являются основными продуктами хим. произ-ва и используются в качестве
исходных веществ в важнейших отраслях хим. пром-сти.
Многообразные - структурные и динамические - функции К. и о. выполняют в
живых организмах, принимая участие во многих биохим. процессах. Как правило,
эти процессы очень чувствительны к кислотности или основности среды (см.
Водородный показатель, Кислотно-щелочное равновесие). Направленное воздействие К. и о.
используется в медицине. Так, разбавленные растворы соляной кислоты
употребляются для усиления секреции желудка, борной - для дезинфицирующих и
вяжущих полосканий и т. д. В то же время при попадании в организм
концентрированных К. и о. возможны сильные ожоги внутр. органов, падение
сердечной деятельности и т. д., приводящие в ряде случаев к гибели организма.
Лит.: Людер В., Цуффанти С., Электронная теория кислот и оснований,
пер. с англ., М., 1950; Усанович М. И., Что такое кислоты и основания, А.-А.,
1953; П о л и н г Л., Общая химия, пер. с англ., М., 1964; Краткая химическая
энциклопедия, т. 2, М., 1963.
Я. М. Варшавский.