БОЙЛЯ ТОЧКА, точка минимума на изотерме реального газа, изображённой
в координатах р - pV (см. рис., р - давление газа, V - занимаемый
газом объем); названа по имени англ, учёного Р. Бойля.
Вблизи Б. т. небольшие участки изотерм реального газа можно приближённо
рассматривать как отрезки горизонтальных прямых, представляющих, согласно Клапейрона
уравнению pV = mRT, изотермы идеального газа (Т - абс. темп-ра R
- газовая постоянная, т - масса газа). Иными словами, Б. т.
определяет темп-ру, при к-рой для данного реального газа применимо уравнение
идеального газа. Участок изотермы ab (слева от Б. т.) соответствует
условиям, когда реальный газ более сжимаем, чем идеальный; участок bс (справа
от Б. т.) cooтветствует условиям меньшей сжимаемости реального газа по сравнению
с идеальным. Слева от Б. т. сказывается преобладающее влияние сил притяжения
между молекулами, облегчающих сжатие газа справа от Б. т.- влияние собственного
объёма молекул, препятствующего сжатию. Вблизи Б. т. эти факторы, отличающие
реальный газ от идеального, взаимно компенсируются.
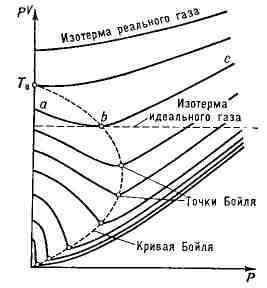
Изотермы реального газа в координатах Р - pV, характеризующие сжимаемость
газа. ТВ - темп-pa Бойля; на изотермах с темп-рой Т > ТВ
точки Бойля отсутствуют.
Линия, соединяющая Б. т. отдельных изотерм, наз. кривой Бойля. Точка этой
кривой, лежащая на оси ординат (р = 0), определяет т. н. темп-ру Бойля ТВ
Для газа, подчиняющегося Ван-дер-Ваальсс, уравнению, ТВ = 3,375
ТВ, где ТК - критическая температура. При Т<ТК
возможно полное сжижение газа под давлением, при Т<ТВ возможно
частичное сжижение газов при дросселировании, см. Джоуля - Томсона явление.
Ю. Н. Дрожжин.
БОЙЛЯ - МАРИОТТА ЗАКОН, один из основных газовых законов, согласно
к-рому при постоянной темп-ре объём V данной массы идеального газа
обратно пропорционален его давлению р, т. е. pV = С = const (рис.
1). Постоянная С пропорциональна массе газа (числу молей) и его абсолютной
температуре.
Закон установлен по опытным данным англ, учёным Р. Бойлем (1662) и
независимо от него франц. учёным Э. Мариоттом (1676).
Б.-М. з. следует из кинетич. теории газов, если принять, что размеры
молекул пренебрежимо малы по сравнению с расстоянием между ними и отсутствует межмолекулярное
взаимодействие. Иными словами, Б.-М. з. выполняется строго для идеального
газа. Для реальных газов, у к-рых влиянием размеров молекул и их
взаимодействием пренебрегать нельзя, Б. - М. з. выполняется приближённо (рис.
2), тем лучше, чем дальше от критического состояния находится газ.
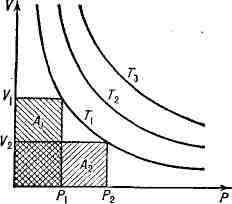
Рис. 1. Зависимость объёма V неизменной массы идеального газа от давления
р при постоянной температуре Т. Изотермы Т1, Т2, Т3
имеют вид равносторонних гипербол, площади А1 и А2 равны
постоянной С.
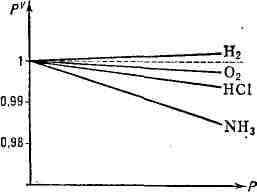
Рис. 2. Отклонение поведения реальных газов от закона Бойля - Мариотта.
Пунктир соответствует линии pV=C